Acid anhydrides comment se forment, applications et exemples

- 2540
- 150
- Raphaël Meyer
Les anhydrides acides Ils sont considérés comme d'une grande importance parmi la grande variété de composés d'origine organique qui existent. Ceux-ci sont présentés comme des molécules qui ont deux groupes acides (substituants organiques dont la formule est RCO-, où R est une chaîne de carbone) unie au même atome d'oxygène.
Il existe également une classe d'anhydrides d'acide qui se trouve couramment: anhydrides carboxyliques, appelés parce que l'acide de démarrage est un acide carboxylique. Pour nommer ceux de ce type dont la structure est symétrique, seul un remplacement des termes doit être fait.

L'expression acide doit être remplacée dans la nomenclature de son acide carboxylique d'origine par le terme d'anhydride, qui signifie "sans eau", sans modifier le reste du nom de la molécule formée. Ces composés peuvent également être générés sur la base d'un ou deux groupes d'acide d'autres acides organiques, tels que l'acide phosphonique ou l'acide sulfonique.
De même, les anhydrides d'acide peuvent être causés sur la base d'un acide inorganique, comme l'acide phosphorique. Cependant, ses propriétés physiques et chimiques, ses applications et autres caractéristiques dépendent de la synthèse réalisée et de la structure de l'anhydride.
[TOC]
Comment se forment les anhydrides acides?
Certains anhydrides acides proviennent de différentes manières, que ce soit en laboratoire ou dans l'industrie. Dans la synthèse industrielle, l'anhydride acétique est pris comme exemple, qui est principalement produit par le processus de carbonilation de la molécule de méthyle d'acétate.
Un autre exemple de cette synthèse est celui de l'anhydride maleico, qui est généré par l'oxydation de la molécule de benzène ou du butane.
Il peut vous servir: Hydroxyde de zinc (Zn (OH) 2)Cependant, dans la synthèse des anihydrides acides en laboratoire, l'accent est mis sur la déshydratation des acides correspondants, tels que la production de l'anhydride éthanique, dans lequel deux molécules d'acide éthaïque sont déshydratées pour donner naissance au composé mentionné.
Une déshydratation intramoléculaire peut également se produire; C'est-à-dire dans la même molécule d'un acide avec deux groupes carboxyle (ou dicarboxylique), mais si l'inverse se produit et qu'un anhydride acide souffre d'hydrolyse, la régénération des acides qui l'origine se produit.
Les anhydrides acides dont les substituants acyl sont égaux, tandis que dans les anhydrides de ce type considérés comme mélangés, ces molécules sont différentes sont différentes.
Cependant, ces espèces sont également générées lorsqu'une réaction se produit entre une halur acide (dont la formule générale est un (RCOX)) avec une molécule de carboxylate (dont la formule générale est r'coooo-)))))))). [2]
Formule générale
La formule générale des anhydrides acides est (RC (O))2Ou, qui est mieux observé dans l'image placée au début de cet article.
Par exemple, pour l'anhydride acétique (de l'acide acétique), la formule générale est (ch3CO)2Ou, écrire de la même manière pour de nombreux autres anhydrides d'acide similaires.
Comme indiqué ci-dessus, ces composés ont presque le même nom de leurs acides précurseurs, et la seule chose qui change est le terme acide par l'anhydride, car les mêmes règles de numérotation des atomes et des substituants doivent être suivies pour réussir avec leur nomenclature.
Applications
Les anhydrides acides ont de nombreuses fonctions ou applications en fonction du terrain qui est étudié, car ils ont une réactivité élevée, elles peuvent être des réactifs précurseurs ou faire partie de nombreuses réactions importantes.
Peut vous servir: pyrolyseUn exemple de ceci est l'industrie, où l'anhydride acétique est produit en grande quantité car c'est la structure la plus simple qui puisse être isolée. Cet anhydride est utilisé comme réactif organique important, comme les esters d'acétate.
Usage industriel
D'un autre côté, l'anhydride Maleico est représenté avec une structure cyclique, utilisé dans la production de couverture à usage industrie. De plus, cette substance sert de diénophile lorsque la réaction de Diels-Alder est effectuée.
De même, il existe des composés qui ont deux molécules d'anhydrides acides dans leur structure, comme l'éthystarboxylique ou le dianhydride dianhydride.
En plus de cela, il existe un anhydride mixte appelé 3'-phosphoadénosín-5'-phosphosulfate, des acides phosphoriques et sulfuriques, qui constitue la coenzyme la plus courante dans les réactions de transfert de sulfate biologique.
Exemples d'anhydrides acides
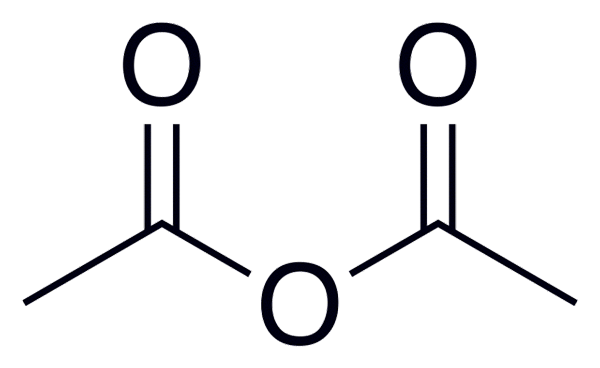 Anhydride acétique
Anhydride acétique Vous trouverez ci-dessous une liste avec les noms de certains anhydrides acides, pour donner quelques exemples de ces composés importants en chimie organique qui peuvent former des composés de structure linéaire ou des anneaux de plusieurs membres:
- Anhydride acétique.
- Anhydride propanoïque.
- Anhydride benzoïque.
- Anhydride de mâle.
- Anhydride succinique.
- Anhydride fthalique.
- Naphtalente -tracarboxylic dianhydride.
- Dianhydride d'éthytertarboxylic.
- Dianhydride benzoquinontérique.
Tout comme ces anhydrides avec de l'oxygène se forment, d'autres composés sont donnés où un atome de soufre peut remplacer l'oxygène à la fois dans le groupe carbonyle et l'oxygène central, comme: par exemple:
Peut vous servir: acétanylide (C8H9NO)- Anhydride tioacétique (choisissez3C (s)2SOIT)
Il y a même le cas de deux molécules acides qui forment des liens avec le même atome de soufre; Ces composés sont appelés Tioanhydrides, a savoir:
- Tioanhydride acétique ((ch3CO))2S)
Les références
- Wikipédia. (2017). Wikipédia. Récupéré de.Wikipédia.org
- Johnson, un. W. (1999). Invitation à la chimie organique. Récupéré des livres.Google.co.aller.
- Acton, Q. POUR. (2011). Hydrolas à l'anhydride acide: progrès de la recherche et de l'application. Récupéré des livres.Google.co.aller
- Bruckner, R., Et harmata, m. (2010). Mécanismes organiques: réactions, stéréochimie et synthèse. Récupéré des livres.Google.co.aller
- Kim, J. H., Gibb, h. J., et iannucci, à. (2009). Anhydrides d'acide cyclique: aspects de la santé humaine. Récupéré des livres.Google.co.aller
- « Types de batteries, caractéristiques et réactions
- Biographie de Julia Pastrana, maladie, relations »

