Types de batteries, caractéristiques et réactions

- 3092
- 502
- Noa Da silva
Sur le marché, vous pouvez obtenir Types de batteries avec ses caractéristiques posséder. Les batteries, qui ne sont rien de plus que les cellules voltaïques, fournissent au consommateur l'avantage de prendre n'importe quel endroit (à condition que les conditions ne soient pas drastiques).
Généralement, les batteries peuvent être achetées isolées; Mais, ils sont également attachés les uns aux autres en série ou parallèle, dont l'ensemble est ce qu'ils appellent les batteries. Et donc parfois les termes «batteries» et «batteries» sont généralement utilisés sans discrimination, même s'ils ne sont pas les mêmes.
 Batteries alcalines: l'un des types de batteries les plus connus
Batteries alcalines: l'un des types de batteries les plus connus Les batteries peuvent avoir d'innombrables couleurs, formes et tailles, comme cela peut être fait d'autres matériaux. De plus, et plus important encore, leur structure interne, où les réactions chimiques qui génèrent de l'électricité sont développées, sert à les différencier les uns des autres.
Par exemple, trois batteries alcalines, l'une des plus courantes sont montrées dans l'image supérieure. Le terme alcalin fait référence au fait que le milieu où se produit la libération et l'écoulement des électrons est basique; c'est-à-dire qu'il a un pH supérieur à 7 et les anions OH prédominent- et d'autres frais négatifs.
[TOC]
Classification PILAS
Avant de traiter certains des différents types de batteries, il est nécessaire de savoir que ceux-ci sont classés globalement comme primaires ou secondaires.
- Batteries primaires
Les batteries primaires sont celles qui une fois consommées doivent être jetées ou recyclées, car la réaction chimique sur laquelle le courant électrique est maintenue est irréversible. Par conséquent, ceux-ci ne peuvent pas être rechargés.
Ils sont principalement utilisés dans les applications où il n'est pas pratique de recharger l'énergie électrique; comme sur les appareils militaires, au milieu du champ de bataille. Ils sont également conçus pour des équipements qui consomment peu d'énergie, afin qu'ils durent plus longtemps; Par exemple, les télécommandes ou les consoles portables (Gameboy, Tetris et Tamagotchi).
Les batteries alcalines, pour citer un autre exemple, appartiennent également au type primaire. Ils ont généralement des formes cylindriques, bien que cela n'implique pas que les batteries cylindriques ne peuvent pas être secondaires ou rechargeables.
- Batteries secondaires
Contrairement aux batteries primaires, les secondaires peuvent être rechargés une fois qu'ils ont manqué d'énergie.
En effet.
Certaines batteries secondaires (appelées batteries) sont généralement petites, tout comme le primaire; Cependant, ils sont alloués à des appareils qui consomment plus d'énergie et pour lesquels l'utilisation de batteries primaires serait économiquement et énergétiquement. Par exemple, les batteries des téléphones portables contiennent des batteries secondaires.
De plus, les batteries secondaires sont conçues pour les grands équipements ou les circuits; Par exemple, les batteries de voitures, qui est composée de plusieurs batteries ou cellules voltaïques.
Ils sont généralement plus chers que les batteries et les batteries primaires, mais pour les utilisations à long terme, ils finissent par être une option plus appropriée et efficace.
- Autres aspects
Les batteries sont classées en primaire ou secondaire; Mais commercialement ou populairement, ils sont généralement classés en fonction de la forme (cylindrique, rectangulaire, boutons), à l'appareil destiné (caméras, véhicules, calculatrices), à leurs noms (aa, aaa, c, d, n, a23, etc. .), Et à ses codes IEC et ANSI.
Il peut vous servir: pyridine: structure, propriétés, utilisations, toxicité, synthèseDe plus, des caractéristiques telles que sa tension (1,2 à 12 volts), ainsi que leur durée de vie et leurs prix utiles, sont responsables de conférer une certaine classification aux yeux du consommateur.
Liste des types de piles
- Batteries en carbone-zinc
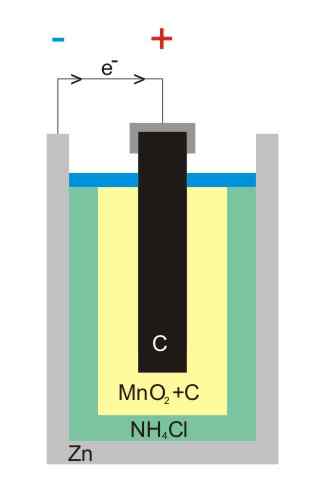 Illustration de batterie en zinc-carbone
Illustration de batterie en zinc-carbone Les batteries en carbone-zinc (également connues sous le nom de cellules Leclanché ou Salinas Pilas) sont l'une des plus primitives et sont actuellement considérées comme presque désaffectées devant d'autres batteries; Surtout, devant les batteries alcalines, qui, bien qu'elles soient un peu plus chères, ils ont une vie et des tensions majeures.
Comme son nom l'indique, ses électrodes sont constituées d'une boîte de zinc et d'une tige de graphite, correspondant à l'anode et à la cathode, respectivement.
Dans la première électrode, l'anode provient les électrons par oxydation du zinc métallique. Ces électrons parcourent ensuite un circuit externe qui alimente l'appareil avec de l'électricité, puis se termine dans la cathode graphite, où le cycle est terminé lorsque le dioxyde de manganèse est réduit dans lequel il est submergé.
Réactions
Les équations chimiques pour les réactions qui se produisent dans les électrodes sont:
Zn (s) → Zn2+(AC) + 2E- (Anode)
2 MNO2(s) + 2e- + 2 NH4Cl (AC) → MN2SOIT3(S) + 2 NH3(AC) + H2Ou (l) + 2 cl- (AC) (Cathode)
Ces batteries sont très similaires à l'alcalin: les deux sont cylindriques (comme ceux de l'image). Cependant, les batteries en carbone-zinc peuvent être distinguées si les caractéristiques étiquetées à l'étranger sont lues en détail, ou si votre code IEC est précédé de la lettre R. Sa tension est de 1,5 V.
- Batteries alcalines
Les batteries alcalines sont très similaires à celles de type carbone-zinc, avec la différence que le milieu où les électrodes contiennent des anions OH-. Ce milieu se compose de forts électrolytes d'hydroxyde de potassium, Koh, qui contribue à l'OH- qui participent et «collaborent» à la migration des électrons.
Il est disponible en différentes tailles et tensions, bien que la plus courante soit 1,5 V. Ce sont peut-être les batteries les plus connues du marché (Duracell, par exemple).
Les réactions qui se produisent dans leurs électrodes sont:
Zn (S) + 2OH-(aq) → ZnO (s) + h2Ou (l) + 2e- (Anode)
2mn2(s) + h2Ou (l) + 2e- → MN2SOIT3(S) + 2OH-(aq) (cathode)
À mesure que la température augmente, les réactions se produisent plus rapidement et plus rapidement, les batteries sont déchargées. Fait intéressant, des rumeurs populaires ont été réalisées pour les mettre dans le congélateur pour augmenter leur temps de vie; Mais, lors du refroidissement, son contenu peut subir d'éventuelles solidifications qui apportent d'autres défauts ou risques avec eux.
Mercure
 Batterie de mercure probable, qui peut être confondue avec la batterie d'oxyde d'argent. Source: Multicherry [CC0].
Batterie de mercure probable, qui peut être confondue avec la batterie d'oxyde d'argent. Source: Multicherry [CC0]. Les batteries au mercure sont très caractéristiques en raison de leur honte particulière des boutons d'argent (image supérieure). Presque tout le monde les reconnaîtrait à première vue. Ils sont également alcalins, mais leur cathode incorpore, en plus du graphite et du dioxyde de manganèse, de l'oxyde de mercure, HGO; qui, après la réduction, devient du mercure métallique:
Zn (S) + 2OH-(AC) → ZnO (S) + H2Ou (l) + 2e-
Hgo (s) + h2O + 2E- → Hg (s) + 2OH-
Peut vous servir: oxyde de magnésium: structure, propriétés, nomenclature, utilisationsNotez comment dans ces réactions cellulaires, les anions OH sont consommés et régénérés-.
Étant de petites batteries, il est destiné aux petits artefacts, tels que les montres, les calculatrices, les commandes de jouets, etc. Qui a utilisé l'un de ces objets aura remarqué qu'il n'est pas nécessaire de changer les batteries pendant presque une "éternité"; qui aurait 10 ans, approximativement.
Oxyde d'argent
 Batteries d'oxyde d'argent. Source: Lukas A, Cze [domaine public].
Batteries d'oxyde d'argent. Source: Lukas A, Cze [domaine public]. Le principal défaut des batteries au mercure est que lorsqu'ils sont jetés, ils représentent un problème grave pour l'environnement, en raison des caractéristiques toxiques dudit métal. Peut-être que cela manque de codes IEC et ANSI. Pour les batteries d'oxyde d'argent, son code CEI est précédé par la lettre S.
L'un des substituts des batteries de mercure correspond à celui de l'oxyde d'argent, beaucoup plus cher, mais d'un impact moins écologique (image supérieure). À ses débuts, ils contenaient du mercure pour protéger le zinc de la corrosion alcaline.
Il est disponible avec une tension de 1,5 V, et ses applications sont très similaires à celles du mercure pila. En fait, à première vue, les deux batteries semblent identiques; Bien qu'il puisse y avoir des batteries d'oxyde d'argent beaucoup plus grandes.
Les réactions dans leurs électrodes sont:
Zn (S) + 2OH-(Ac) → Zn (OH)2(s) + 2 e-
Agir2Ou (s) + 2h+(AC) + 2E- → 2ag (s) + h2Ou (l)
L'eau souffre par la suite de l'électrolyse, en décomposition sur les ions H+ et oh-.
Notez qu'au lieu de mercure, il se forme dans la cathode en métal argenté.
- Nickel-Cadmium Pilas (Nicad)
 Batterie Nicd. Source: Lordder [CC0].
Batterie Nicd. Source: Lordder [CC0]. À partir de ce moment, les batteries ou batteries secondaires sont considérées. Comme le mercure, les batteries en nickel-cadmium sont nocives pour l'environnement (pour la faune et la santé) par le cadmium métal.
Ils se caractérisent par générer des courants électriques élevés et un grand nombre de fois peuvent être rechargés. En fait, 2000 fois peuvent être rechargés, ce qui est égal à une durabilité extraordinaire.
Ses électrodes sont constituées d'hydroxyde d'oxyde de nickel, d'enfant (OH), de cathode et de cadmium métallique pour l'anode. La Fondation chimique, en substance, reste la même: le cadmium (au lieu du zinc) perd des électrons et le cadmium nio (oh) les gagne.
Les réactions semi -cées sont:
CD (S) + 2OH-(AC) → CD (OH)2(s) + 2e-
2nio (oh) (s) + 2h2Ou (l) + 2e- → 2ni (OH)2(s) + oh-(AC)
Oh anions-, Encore une fois, ils viennent de l'électrolyte Koh. Les batteries de Nicad finissent donc par générer des hydroxydes de nickel et de cadmium métallique.
Ils sont utilisés individuellement ou couplés dans des packages (comme l'image jaune, supérieure). Ils viennent donc, dans des forfaits grands ou petits. Les petits trouvent une utilisation dans les jouets; Mais les grands sont destinés aux avions et aux véhicules électriques.
- Nickel-hydro Metallic Pilas (NI-HM)
 Batteries ni-hm. Source: RAMSH NG de Flickr (https: // www.Flickr.com / photos / rameshng / 5645036051)
Batteries ni-hm. Source: RAMSH NG de Flickr (https: // www.Flickr.com / photos / rameshng / 5645036051) Une autre batterie ou batterie bien connue, et qui dépasse les capacités énergétiques de Nicad, est ni-hm (nickel et hydrure métallique). Il peut venir en format cylindrique (batteries conventionnelles, image supérieure), ou couplées dans une batterie.
Chimiquement présent presque les mêmes caractéristiques que les batteries Nicad, avec la principale différence basée dans son électrode négative: la cathode n'est pas le cadmium, mais un alliage intermétallique de terres rares et de métaux de transition.
Peut vous servir: séchoir rotatif: fonctionnement, à quoi sert-il, pièces, applicationsCet alliage est responsable de l'absorption d'hydrogène formé pendant la charge, générant un hydrure métallique complexe (d'où la lettre H en son nom).
Bien que les batteries Ni-HM fournissent plus d'énergie (environ 40% de plus), sont plus chères, elles portent plus rapidement et ne peuvent pas être rechargées du même nombre de fois que les batteries Nicad; c'est-à-dire qu'ils ont une durée de vie utile plus faible. Cependant, ils n'ont pas l'effet de mémoire (perte de performances de la batterie en ne faisant pas complètement disparaître).
C'est pour cette raison qu'ils ne devraient pas être utilisés dans les machines fonctionnant à long terme; Bien que ce problème ait été emballé avec les batteries LSD-NIHM. De même, les batteries ou batteries Ni-HM ont des caractéristiques thermiques très stables, fonctionnant dans une large gamme de températures sans représenter un risque.
Réactions
Les réactions qui se produisent dans leurs électrodes sont:
Ni (oh)2(s) + oh-(ac) ⇌ nio (oh) (s) + h2Ou (l) + e-
H2Ou (l) + m (s) + e- ⇌ oh-(AC) + MH (S)
- Batteries ion-litio
 Batterie lithium-ion d'un ordinateur portable. Source: Kristoferb de Wikipedia.
Batterie lithium-ion d'un ordinateur portable. Source: Kristoferb de Wikipedia. Dans les batteries et les batteries au lithium, ils sont basés sur la migration des ions Li+, qui sont transférés de l'anode à la cathode, produit des répulsions électrostatiques par la charge positive croissante.
Certains peuvent se recharger, comme les batteries d'ordinateurs portables (image supérieure) et d'autres, cylindriques et rectangulaires (lisses2, Lisocl2 ou limousine2) Non.
Les batteries ion-litio sont caractérisées par une très lumière et une énergie, ce qui leur permet d'être utilisé dans de nombreux appareils électroniques, tels que les smartphones et l'équipement médical. Ils souffrent également à peine de l'effet de la mémoire, leur densité de charge dépasse celles des batteries et batteries Nicad et Ni-HM, et retardent davantage dans le téléchargement.
Cependant, ils sont très sensibles aux températures élevées, même en explosant; Et en plus, ils sont généralement plus chers devant d'autres batteries. Même ainsi, sur le marché, les batteries au lithium sont vues avec de bons yeux, et de nombreux consommateurs les qualifient comme les meilleurs.
- Batteries au plomb acide
 Batterie de batterie de voiture carf typique. Source: tntflash [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Batterie de batterie de voiture carf typique. Source: tntflash [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Et enfin, les bactéries en plomb acide, comme son nom l'indique, ne contient pas d'ions OH- mais h+; Plus précisément, une solution concentrée d'acide sulfurique. Les cellules voltaïques sont à l'intérieur de leurs boîtes (image supérieure), où trois ou six peuvent être couplés en série, donnant une batterie de 6 ou 12 V, respectivement.
Il est capable de générer de grandes quantités de charge électrique, et parce qu'ils sont très lourds, ils sont destinés aux applications ou aux appareils qui ne peuvent pas être transportés manuellement; Par exemple, les voitures, les panneaux solaires et les sous-marins. Cette batterie acide est la plus ancienne et est toujours en vigueur dans l'industrie automobile.
Vos électrodes sont en plomb: PBO2 Pour la cathode et le plomb métallique spongieux pour l'anode. Les réactions qui y surviennent sont:
PB (S) + HSO-4(aq) → PBSO4(s) + h+(aq) + 2e-
PBO2(s) + HSO-4(aq) + 3h+(aq) + 2e- → PBSO4(s) + 2h2Ou (l)
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Odunlade Emmanuel. (24 juillet 2018). Différents types de batteries et les applacations. Digestion de circuit. Récupéré de: circuitdigest.com
- Prba. (s.F.). Types de batteries. Récupéré de: prba.org
- Isidor Buchman. (2019). Quelle est la meilleure batterie? Université de batterie. Récupéré de: Batteryuniversity.com
- Les sociétés McGraw-Hill. (2007). Chapitre 12: Batteries. [PDF]. Récupéré de: Oakton.Édu
- Shapley Patricia. (2012). Types de batterie communes. Université de l'Illinois. Récupéré de: butane.Chem.Uiuc.Édu
- Attitude écologique. (22 janvier 2017). Types de batteries: Guide complet avec batteries et batteries qui existent. Récupéré de: eccologique.com
- « Biographie Tomás Mejía, carrière militaire, tir
- Acid anhydrides comment se forment, applications et exemples »

