Affinité électronique

- 3817
- 1108
- Jade Duval
Qu'est-ce que l'affinité électronique?
La Affinité électronique Il est défini comme la quantité d'énergie libérée lorsqu'une mole d'atomes à l'état gazeux est combinée avec une mol d'électrons pour former une taupe d'anions, également à l'état gazeux. En d'autres termes, il fait référence au négatif de la variation d'enthalpie du processus suivant:
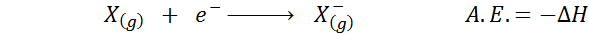
Comme son nom l'indique, l'affinité électronique (A.ET.) C'est une mesure de la tendance qui a un atome pour rejoindre un électron. C'est-à-dire qu'il mesure l'affinité d'un atome pour les électrons.
Interprétation de l'affinité électronique
En raison de la façon dont il est défini, une affinité électronique élevée implique que la variation de l'enthalpie est très négative. Ceci, à son tour, indique que le processus est énergiquement favorable et que les produits sont plus stables que les réactifs. Pour cette raison, nous pourrions également dire que l'affinité électronique est une mesure indirecte de la stabilité d'un anion.
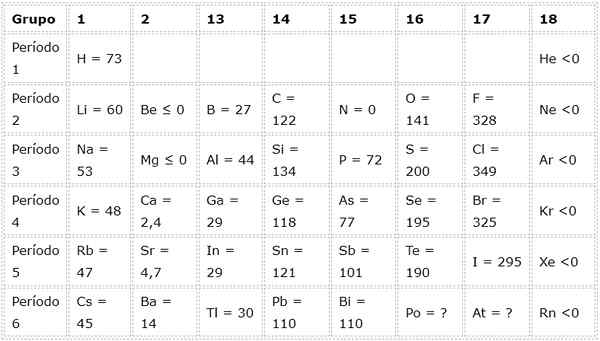
Plus l'affinité électronique d'un atome est grande, plus la tendance à former l'anion est grande. C'est pourquoi les atomes tels que le chlore, dont l'affinité électronique est de 349 kJ / mol, ont tendance à former facilement des anions (dans ce cas, l'anion chlorure), tandis que d'autres atomes tels que le magnésium, dont l'affinité électronique est négative, ne forment pas d'anions anions anions.
Clarification sur l'affinité électronique et l'énergie d'ionisation
Plusieurs fois, vous considérez l'affinité électronique comme l'opposé de l'énergie d'ionisation (la tendance d'un atome gazeux à perdre un électron), mais ce n'est pas le cas. Considérez, par exemple, un atome x.
Il peut vous servir: Tusfrano: structure chimique, propriétés et utilisationsSon affinité électronique fait référence au changement d'énergie du processus indiqué ci-dessus dans la première équation. Cependant, son énergie d'ionisation fait référence au changement d'énergie lorsque l'atome perd un électron:
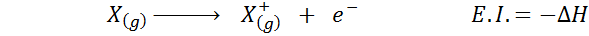
Bien que cette réaction semble être la réaction inverse à la précédente.
Ce qui détermine l'affinité électronique?
Pour savoir quelles caractéristiques d'un atome influencent la valeur de son affinité électronique, la stabilité de l'atome d'origine doit être prise en compte, ainsi que celle de l'anion qui est formé. Si l'anion est plus stable que l'atome, alors l'affinité électronique sera élevée, sinon elle sera faible ou même négative.
Mais comment savoir lequel des deux espèces est le plus stable? Pour cela, nous comptons sur deux facteurs:
- Configuration électronique. Il y a plus de paramètres électroniques stables que les autres. En général, la configuration complète de la couche (comme les gaz nobles) est le plus stable de tous. Ensuite, il est suivi de la configuration de la couche semi-lallena, dans laquelle toutes les orbitales de la couche de valence ont la moitié des électrons qu'ils pourraient avoir (par exemple, 4S14p3).
- Répulsion électronique. Si un anion de charge -1 est comparé, avec un anion de charge -2, dans le deuxième cas, il y aura beaucoup plus de répulsion entre les électrons, ce qui déstabilise l'anion.
Tendance d'affinité électronique périodique
 Graphique montrant les affinités électroniques des 9 premiers éléments du tableau périodique
Graphique montrant les affinités électroniques des 9 premiers éléments du tableau périodique L'affinité électronique est l'une des propriétés périodiques des éléments. C'est-à-dire que c'est une propriété qui varie de manière prévisible d'un élément à un autre en fonction de sa position dans le tableau périodique. En termes généraux, l'affinité électronique augmente à mesure que la taille de l'atome diminue.
Il peut vous servir: formule semi-développée: Qu'est-ce qu'il y a et des exemples (méthane, propane, butane ...)En ce sens, la taille des atomes varie en fonction de la période et du groupe dans lequel il est situé, donc son affinité électronique varie également comme expliqué ci-dessous:
Variation de l'affinité électronique sur une période
Au moins pour les éléments représentatifs (ceux appartenant aux blocs S et P du tableau périodique), on peut observer que l'affinité électronique a une tendance générale à augmenter de gauche à droite, en raison de l'augmentation de la charge nucléaire efficace qui est capable d'attirer des électrons avec une plus grande force.
Par exemple, si nous prenons la 3e période du tableau périodique, nous pouvons voir que l'affinité électronique du Li (60 kJ / mol) est inférieure à celle de l'oxygène (141 kJ / mol) et c'est moins que celle du fluorure (328 kJ / mol).
Des exceptions
La règle précédente n'est pas toujours remplie.
Premièrement, lors du passage des métaux alcalins aux alcalineurs, l'affinité électronique diminue. En effet, pour les métaux alcalins (configuration électronique NS1) Il est favorable de capturer un électron, car ils finiraient de remplir leur orbite.
Dans le cas des alcalinéros (configuration électronique ns2) Capturer un électron est défavorable car ils ont déjà leur orbital complet. La même chose se produit lorsque vous passez des halogènes (qui ont les affinités électroniques de tous les éléments) aux gaz nobles.
Variation de l'affinité électronique dans tout un groupe
Dans le cas des groupes, le comportement est encore moins prévisible. La règle générale est que le a.ET. augmente de bas en haut, dans la même direction qui diminue le rayon atomique. Pour les métaux alcalins et halogènes, cette règle est assez bien respectée. Cependant, cela ne se produit pas avec la plupart des autres groupes.
Peut vous servir: hydroxyde de cobaltExemples d'affinité électronique de certains éléments représentatifs
Le tableau suivant montre les valeurs d'affinité électronique dans (kj / mol) de Les éléments représentatifs Trié par groupe:
Voici quelques exemples d'affinité électronique ainsi que la réaction à laquelle ils se réfèrent:
1. Affinité électronique hydrogène
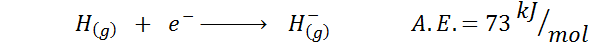
2. Affinité électronique de l'oxygène
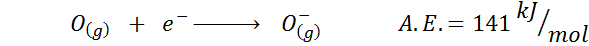
3. Affinité électronique anion
Un autre exemple courant est le cas de l'affinité électronique d'un anion tel que ou-. La A.ET. Dans ce cas, il est donné par l'énergie associée au processus suivant:
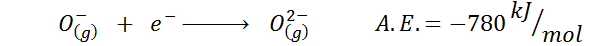
Comme on peut le voir, cette affinité électronique est fortement négative, même si l'ion ou2- Il a la configuration électronique néon (un gaz noble) et d'être un ion très commun dans de nombreux solides ioniques.
La raison en est que la répulsion des charges négatives dans le ou2- déstabilise cet ion état gazeux, mais à l'état solide, la charge est stabilisée par les cations qui l'entourent.

