Structure d'acriLonitrile, propriétés, production, utilisations

- 3289
- 772
- Lucas Schneider
Il acrilitrile C'est un composé organique dont la formule condensée est Cho2CHCN. C'est l'un des nitriles les plus simples qui existent. Chimie et structurellement ce n'est rien de plus que le produit de l'union entre un groupe vinyle, Cho2= Ch- et un groupe de cyanure de nitrile, C≡N. C'est une substance avec un grand impact industriel sur le monde des plastiques.
Physiquement, c'est un liquide incolore, avec une certaine odeur d'oignon, et celle dans l'état impur présente des tons jaunâtres. Il est très inflammable, toxique et peut-être cancérigène, il est donc classé comme une substance extrêmement dangereuse. Ironiquement, avec elle, ce sont des plastiques fabriqués et des jouets de la vie quotidienne, comme Tupperware et les blocs LEGO.
 Des polymères d'acriLonitrile sont présents dans le plastique Tupperware. Source: Stebulus via Wikipedia.
Des polymères d'acriLonitrile sont présents dans le plastique Tupperware. Source: Stebulus via Wikipedia. À échelles industrielles, Acrillonitril. Presque toute la quantité produite est destinée à la fabrication de plastiques, basée sur des homopolymères, tels que le polyacrylonitrile, ou dans des copolymères, tels que l'acrillonitrile-butadiène-styrène.
[TOC]
Structure d'acriLonitrile
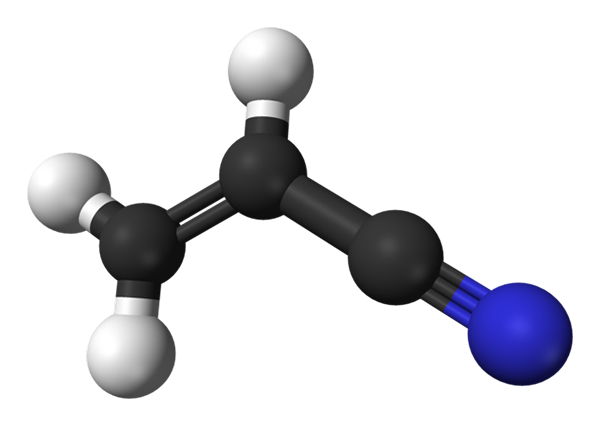 Structure moléculaire de l'acriLonitrile. Source: Benjah-Bmm27 / Domaine public
Structure moléculaire de l'acriLonitrile. Source: Benjah-Bmm27 / Domaine public Dans l'image supérieure, nous avons la molécule acrillonitrile représentée avec un modèle de sphères et de barres. Les sphères noires correspondent aux atomes de carbone, tandis que les atomes blancs et bleus à l'hydrogène et à l'azote, respectivement. La gauche, ch2= Ch- correspond au groupe vinyle, et à droite, au groupe cyano, C≡N.
La molécule entière est plate, car les carbones du groupe vinyle ont une hybridation SP2. Pendant ce temps, le carbone du groupe Ciano a une hybridation SP, à côté de l'atome d'azote dans une ligne qui repose sur le même plan que le reste de la molécule.
Le groupe CN contribue à la polarité à la molécule, donc la molécule CHO2CHCN établit un dipôle permanent où la densité électronique la plus élevée est dirigée vers l'atome d'azote. Par conséquent, dipol-dipol.
Peut vous servir: quelle est la périodicité chimique?Les molécules ch2Les CHCN sont plats, pouvant s'attendre à ce que dans leurs cristaux (solidifiés à -84 ºC), ils soient disponibles les uns sur les autres comme des feuilles ou des feuilles de papier, afin que leurs dipôles ne se repoussent pas.
Propriétés
Apparence physique
Liquide incolore mais avec des tons jaunâtres quand il présente des impuretés. Quand c'est le cas, ils recommandent de le distiller avant son utilisation. Il est volatil et a également une odeur intense similaire à l'oignon.
Masse molaire
53 064 g / mol
Point de fusion
-84 ºC
Point d'ébullition
77 ºC
point de rupture
-5 ºC (tasse fermée)
0 ºC (tasse ouverte)
Température d'auto-direction
481 ºC
Densité
0,81 g / cm3
Densité de vapeur
1,83 en relation aérienne.
La pression de vapeur
109 mmHg à 25 ºC
Solubilité
Dans l'eau, il a une solubilité de 74 g / L à 25 ºC. L'acrillonitrile est également considérablement soluble dans l'acétone, l'huile, l'éthanol, l'acétate d'éthyle et l'éthanile benzène.
Décomposition
Lorsqu'il libère thermiquement du cyanure d'hydrogène toxique, des oxydes de carbone et des oxydes d'azote.
Production
Processus sohio
L'acryonitrile peut se produire à des échelles massives à travers de nombreuses réactions et processus chimiques. De tous, le processus Sohio est le plus utilisé, qui se compose de l'amaxydation catalytique du propylène. Dans un réacteur à lit fluidisé, le propylène est mélangé avec de l'air et de l'ammoniac à une température autour de 400 et 510 ºC, où ils réagissent sur des catalyseurs solides.
Les réactifs entrent dans le réacteur une fois, se déroulant la réaction suivante:
2ch3−ch = ch2 + 2 NH3 + 3 o2 → 2 ch2= Ch-C≡N + 6 H2SOIT
Notez que l'oxygène est réduit à l'eau, tandis que le propylène oxyde l'acrillonitrile. D'où le nom «Amoxydation», car c'est une oxydation qui implique la participation de l'ammoniac.
Peut vous servir: bouillir: concept, types et exemplesProcessus alternatifs
En plus du processus SOHIO, d'autres réactions peuvent être mentionnées qui permettent l'obtention d'acriLonitrile. De toute évidence, tous ne sont pas évolutifs, ou du moins d'une manière suffisante et généreuse, ni générer des produits avec des performances élevées ou de la pureté.
L'acrylonitrile est synthétisé, à nouveau à partir du propylène, mais le faisant réagir avec l'oxyde nitrique sur les catalyseurs PBO2-Zro2 en forme d'aérogel. La réaction est la suivante:
4 ch3−ch = ch2 + 6 Non → 4 CHO2= Ch-C≡N + 6 H2Ou + n2
Une réaction qui n'implique pas de propylène est celle qui commence par l'oxyde d'éthylène, qui réagit avec le cyanure d'hydrogène pour se transformer en cyanohydrine à l'éthylène; Et plus tard, il se déshydrater à une température de 200 ºC dans l'acrilonitrile:
Eto + hcn → ch2Ohch2CN
Ch2Ohch2CN + Q (200 ºC) → CH2= Ch-C≡N + H2SOIT
Une autre réaction beaucoup plus directe est l'ajout de cyanure d'hydrogène sur l'acétylène:
HC≡CH + HCN → CH2= Ch-C≡N
Cependant, de nombreux produits secondaires sont formés, de sorte que la qualité de l'acriLonitrile est plus faible par rapport à celle du processus Sohio.
En plus des substances susmentionnées, le lactonitrile, le propionitril.
Applications
 Les legos sont principalement fabriqués avec du plastique ABS, un copolymère dans lequel l'acrillonitrile fait partie. Source: pxhere.
Les legos sont principalement fabriqués avec du plastique ABS, un copolymère dans lequel l'acrillonitrile fait partie. Source: pxhere. L'acrillonitrile est une substance indispensable pour l'industrie des plastiques. Plusieurs de ses plastiques dérivés sont très connus. Tel est le cas des copolymères acrilonitrilo-butadiène-styrène (ABS), avec lesquels les morceaux des laïcs sont fabriqués. Nous avons également des fibres acryliques, élaborées avec l'homopolymère polyacrylonitrile (PAN).
Peut vous servir: saponificationParmi d'autres plastiques contenant l'acrillonitrile en tant que monomère, ou qui en dépendent pour sa fabrication, nous avons: acrylene stretch (SAN), Butadiène acrylonitrile (NBR), acrylate de stretch acrilonitrile (ASA), polyacrylamide et grouchis synthétiques et resins nitriles (ASA), polyacrylamide et synthétiques et resins nitriles et resins nitriles (ASA), polyacrylamide et synthétiques et resins nitriles.
Pratiquement, tout polymère naturel, comme le coton, peut être modifié en incorporant ses structures moléculaires dans l'acrillonitrile. Ainsi, les dérivés de nitrile sont obtenus, ce qui fait la chimie de l'acrylonitrile très large.
L'une de ses utilisations en dehors du monde des plastiques est comme des pesticides mélangés à du tétrachlorure de carbone. Cependant, en raison de son terrible impact sur l'écosystème marin, ces pesticides se sont interdits ou sont soumis à de fortes restrictions.
Des risques
L'acrillonitrile est une substance dangereuse, il doit donc être manipulé avec des soins extrêmes. Toute exposition inappropriée ou excessivement prolongée à ce composé peut être mortelle, soit par inhalation, apport ou contact physique.
Il doit être maintenu autant que possible de toute source de chaleur, car il s'agit d'un liquide volatil et très inflammable. Il ne devrait pas non plus être en contact avec l'eau, car il réagit violemment avec elle.
En plus de cela, c'est une substance peut-être cancérigène, qui a été associée aux cancers du foie et du poumon. Ceux qui ont été exposés à cette substance ont augmenté les niveaux de tiocyanate excrétés dans l'urine et le cyanure de sang.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Acrylonitrile. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Acrylonitrile. Base de données PubChem., CID = 7855. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Elsevier B.V. (2020). Acrylonitrile. ScienceDirect. Récupéré de: ScienceDirect.com
- Korry Barnes. (2020). Qu'est-ce que l'acrylonitrile? - Utilisation et propriétés. Étude. Récupéré de: étudier.com
- Pajonk, g.M., Manzalji, t. (1993). Synthèse de l'acrylonitrile à partir de mélanges de propylène et d'oxyde nitrique sur PBO2-Zro2 Catalyseurs aérogel. Catal Lett vingt-et-un, 361-369. est ce que je.org / 10.1007 / BF00769488
- « Caractéristiques de programmation dynamique, exemple, avantages, inconvénients
- Qu'est-ce qu'un processus isotherme? (Exemples, exercices) »

