Qu'est-ce qu'un processus isotherme? (Exemples, exercices)

- 4857
- 226
- Louna Baron
Il processus isotherme ou l'isotherme est un processus thermodynamique réversible dans lequel la température reste constante. Dans un gaz, il existe des situations dans lesquelles un changement dans le système ne produit pas de variations de température, mais en caractéristiques physiques.
Ces changements sont des changements de phase, lorsque la substance passe du solide au liquide, de liquide de gaz ou vice versa. Dans de tels cas, les molécules de substance réajustent leur position, ajoutant ou extraire l'énergie thermique.
 Figure 1. Les Carambans qui fondent sont un exemple de processus isotherme. Source: Pixabay.
Figure 1. Les Carambans qui fondent sont un exemple de processus isotherme. Source: Pixabay. L'énergie thermique nécessaire pour qu'un changement de phase se produise dans une substance est appelé chaleur latente ou chaleur de transformation.
Une façon d'obtenir un processus isotherme est de contacter la substance qui sera le système étudié avec un dépôt thermique externe, qui est un autre grand système de capacité calorique. De cette façon, un échange de chaleur aussi lent se produit, que la température reste constante.
Ces types de processus sont souvent donnés dans la nature. Par exemple, chez l'homme lorsque la température corporelle augmente ou descend, nous nous sentons malades, car dans notre corps, de nombreuses réactions chimiques qui maintiennent la vie sont données à température constante. Ceci est valable pour le sang chaud en général.
D'autres exemples sont ceux de la glace qui fond de la chaleur à l'arrivée du printemps et des glaçons.
[TOC]
Exemples de processus isothermes
-Le métabolisme des animaux à sang chaud est effectué à température constante.
 Figure 2. Les animaux à sang chaud ont des mécanismes pour maintenir la température constante. Source: Wikimedia Commons.
Figure 2. Les animaux à sang chaud ont des mécanismes pour maintenir la température constante. Source: Wikimedia Commons. -Lorsque l'eau bouillonne, un changement de phase se produit, de liquide de gaz et que la température reste constante à environ 100 º C, car d'autres facteurs peuvent influencer la valeur.
-La glace qui fond est un autre processus isotherme fréquent, ainsi que de placer de l'eau dans le congélateur pour faire des glaçons.
Peut vous servir: optique géométrique: quelles études, lois, applications, exercices-Les moteurs automobiles, les réfrigérateurs, ainsi que de nombreux autres types de machines, fonctionnent correctement dans une certaine plage de température. Pour maintenir la température appropriée, les appareils appelés Thermostats. Dans sa conception, divers principes de fonctionnement sont utilisés.
Cycle de Carnot
Un moteur Carnot est une machine idéale à partir de laquelle le travail est obtenu grâce à des processus entièrement réversibles. C'est une machine idéale car elle ne considère pas les processus qui dissipent l'énergie, comme viscosité de la substance qui fait le travail, ni la friction.
Le cycle carnot se compose de quatre étapes, dont deux sont précisément isothermes et les deux autres adiabatiques. Les étapes isothermes sont la compression et l'expansion d'un gaz responsable de la production du travail utile.
Un moteur de voiture fonctionne avec des principes similaires. Le mouvement d'un piston à l'intérieur du cylindre est transmis à d'autres parties de la voiture et produit un mouvement. Il n'a pas le comportement d'un système idéal comme le moteur Carnot, mais les principes thermodynamiques sont courants.
Calcul du travail effectué dans un processus isotherme
Pour calculer le travail effectué par un système lorsque la température est constante, la première loi de la thermodynamique doit être utilisée, ce qui indique:
Δu = q - w
C'est une autre façon d'exprimer la conservation de l'énergie dans le système, présenté à travers ΔU ou un changement d'énergie, Q Comme la chaleur fournie et enfin W, qui est le travail effectué par ledit système.
Supposons que le système en question soit un gaz idéal contenu dans le cylindre d'un piston de zone mobile POUR, Qu'est-ce qui fonctionne lorsque son volume V changement de V1 pour V2.
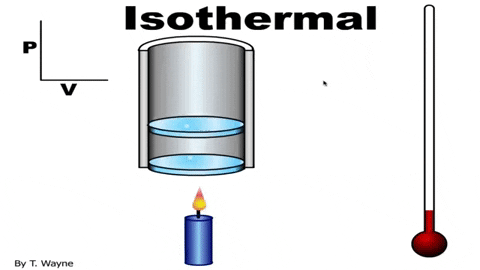 figure 3. Dans un processus isotherme, le gaz se dilate dans le piston sans changer la température. Source: YouTube.
figure 3. Dans un processus isotherme, le gaz se dilate dans le piston sans changer la température. Source: YouTube. L'équation de statut de gaz idéal est PV = NRT, qui relie le volume à la pression P et la température T. Les valeurs de n et r sont constantes: n est le nombre de moles de gaz et r la constante de gaz. Dans le cas d'un processus isotherme, le produit PV C'est constant.
Peut vous servir: constantes antoine: formules, équations, exemplesEh bien, le travail effectué est calculé en intégrant un petit travail différentiel, dans lequel une force F produit un petit déplacement DX:
Dw = fdx = padx
Comme ADX est précisément la variation du volume Dv, ensuite:
Dw = pdv
Pour obtenir un travail total dans un processus isotherme, l'expression de DW est intégrée:
La pression P et le volume V Ce sont des graphiques dans un diagramme P-V Comme celui montré sur la figure et le travail effectué équivaut à la zone sous la courbe:
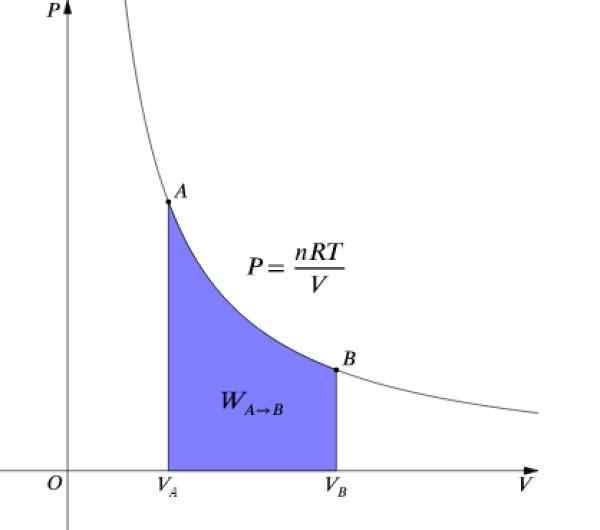 Figure 4. Diagramme P-V d'un processus isotherme. Source: Wikimedia Commons.
Figure 4. Diagramme P-V d'un processus isotherme. Source: Wikimedia Commons. Comme ΔU = 0 Puisque la température reste constante, dans un processus isotherme, il doit:
Q = W
- Exercice 1
Un cylindre fourni avec un piston mobile contient un gaz idéal à 127 ºC. Si le piston se déplace jusqu'à ce que le volume initial soit réduit 10 fois, en gardant la température constante, trouvez la quantité de moles contenue dans le cylindre, si le travail effectué sur le gaz est 38.180 J.
Fait: R = 8.3 J / mol. K
Solution
La déclaration affirme que la température reste constante, alors nous sommes en présence d'un processus isotherme. Pour le travail effectué sur le gaz, vous avez l'équation précédemment déduite:

127 º C = 127 + 273 K = 400 K
N clair, le nombre de moles:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 J / mol.K x 400 K x Ln (V2/ 10v2) = 5 moles
Un signe négatif était avant le travail. Le lecteur attentif aura remarqué dans la section précédente que W a été défini comme "le travail effectué par le système" et a un signe +. Ainsi, le "travail effectué sur le système" a un signe négatif.
Il peut vous servir: deuxième condition d'équilibre: explication, exemples, exercices- Exercice 2
Vous avez de l'air dans un cylindre fourni avec un piston. Initialement, il y en a 0.4 m3 de pression à 100 kPa et 80 º C température. L'air est comprimé à 0.1 m3 s'assurer que la température à l'intérieur du cylindre reste constante pendant le processus.
Déterminez la quantité de travail effectuée pendant ce processus.
Solution
Nous utilisons l'équation pour les travaux précédemment déduits, mais le nombre de moles est inconnu, qui peut être calculé avec l'équation des gaz idéaux:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = p1V1 / Rt = 100000 pa x 0.4 m3 / 8.3 J / mol. K x 353 K = 13.65 mol
W = n.R.T ln (v2/ V1) = 13.65 mol x 8.3 J / mol. K x 353 k x ln (0.1/0.4) = -55.442.26 J
Encore une fois, le signe négatif indique que le travail a été effectué sur le système, ce qui se produit toujours lorsque le gaz est comprimé.
Les références
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. Volume 1. Mc Graw Hill.
- Cengel, et. 2012. Thermodynamique. 7mame Édition. McGraw Hill.
- Figueroa, D. (2005). Série: Physique pour la science et l'ingénierie. Volume 4. Fluides et thermodynamique. Édité par Douglas Figueroa (USB).
- Chevalier, r. 2017. Physique pour les scientifiques et l'ingénierie: une approche stratégique.
- SERAY, R., Vulle, c. 2011. Fondamentaux de la physique. 9n / A Cengage Learning.
- Wikipédia. Processus isotherme. Récupéré de: dans.Wikipédia.org.
- « Structure d'acriLonitrile, propriétés, production, utilisations
- Phrases consécutives quelles sont et 75 exemples »


