Structure, fonctions et inhibiteurs de l'acétylcholinestérase
- 1796
- 345
- Adam Mercier
La acétylcholinestérase (Acétylcholine acétylsa hydrolese, EC 3.1.1.7) C'est une enzyme qui se trouve principalement dans le système nerveux central. Sa tâche, comme son nom l'indique, est le traitement hydrolytique du neurotransmetteur acétylcholine.
C'est une enzyme associée à la membrane cellulaire qui fonctionne avec le récepteur de l'acétylcholine pour médier l'excitation des cellules postsynaptiques et dont le mécanisme catalytique est étonnamment rapide.
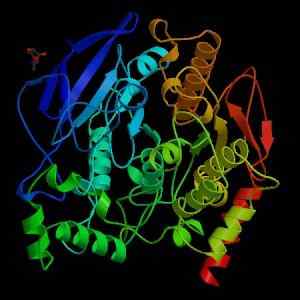
 Structure de l'acétylcholinestérase (Source: Wikimedia Commons)
Structure de l'acétylcholinestérase (Source: Wikimedia Commons) Du point de vue mécanique, cette enzyme peut être considérée comme une sérin-hydrolase, et dans le domaine catalytique de son site actif, il contient la triade d'acides aminés caractéristique des protéases: sérine, histidine et résidu acide. Cependant, le résidu acide est un glutamate, tandis que les protéases ont normalement un aspartate.
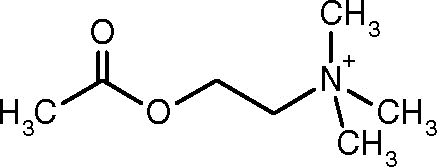 Structure de l'acétylcholine (source: Alinebloom [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Structure de l'acétylcholine (source: Alinebloom [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) L'une des premières observations qui a lié l'activité catalytique de l'acétylcholinestérase avec des tissus nerveux et des tissus musculaires cholinergiques a été celui réalisé par Dale en 1914; Par la suite, il a été déterminé qu'il est également présent dans les neurones non colloriques et dans les cellules hématopoïétiques, ostéogéniques et néoplasiques.
Grâce à l'étude de divers organismes, il est actuellement connu que l'enzyme est présente dans la membrane de différents types de cellules telles que les érythrocytes, les cellules nerveuses et musculaires, les organes électriques et autres.
[TOC]
Structure
Structure tertiaire et quaternaire
Dans des conditions naturelles ou "in vivo ", L'acétylcholinestérase est une enzyme polymorphe qui se compose de plusieurs sous-unités catalytiques de plus ou moins de 80 kDa, qui sont assemblées pour former une structure oligomère (de plusieurs sous-unités).
La quantité et la complexité de ces sous-unités dépendent du type de cellule et des espèces considérées.
Certaines des formes enzymatiques les plus complexes ont des sous-unités catalytiques avec des formes globulaires (g) ou asymétriques (A) liées par des ponts disulfure. Les ponts disulfure sont des liaisons covalentes formées entre deux molécules de soufre des groupes Tiol (-SH) de deux résidus de l'acide du code de la cystéine.
Chaque sous-université G contient un seul site actif, tandis que les sous-unités A sont généralement caractérisées par la présentation de trois domaines structurels, à savoir: les sous-unités catalytiques, les queues de collagène riches en glycine, hydroxiproline et déchets d'hydroxiline et autres queues non collagènes (différentes de Collagen).
Les formes asymétriques de l'acétylcholinestérase sont connues sous le nom d'A12, A8 et A4, qui ont respectivement des sous-unités catalytiques 12, 8 et 4.
Peut vous servir: flore et faune d'Afrique: espèces représentativesGénéralement, les résidus du domaine catalytique dans le site actif sont dans une région «profonde» des sous-unités, qui pourrait être considérée comme contradictoire en ce qui concerne la vitesse rapide de la réaction qui catalyse cette enzyme et l'inaccessibilité apparente du substrat à ces sites.
Indépendamment du polymorphisme enzymatique, les sous-unités globulaires et asymétriques ont des activités catalytiques similaires.
Variantes
Certaines cellules autres que les cellules nerveuses, car les érythrocytes produisent des enzymes à prédominance globulaire, dimétrique et principalement associée.
L'enzyme des érythrocytes, bien que d'une complexité moins structurelle, est également une enzyme amphipatique, dont le domaine catalytique actif se trouve dans la grande région hydrophile, tandis que le domaine hydrophobe, qui contient la région carboxyle terminale, est responsable de la maintenance dans la membrane.
Structure primaire
Une grande partie des connaissances actuelles sur la séquence de l'acétylcholinestérase proviennent de l'étude de l'enzyme de Torpille de Californica, Un poisson linéaire qui vit dans l'océan Pacifique et qui a été traditionnellement utilisé comme organisme modèle pour l'étude de différentes protéines du système nerveux.
Les sous-unités de l'acétylcholinestérase sont synthétisées comme des protéines pro qui sont ensuite traitées pour donner naissance à des sous-unités mûres. Chaque sous-unité se compose d'un polypeptide d'environ 575 acides aminés et de 65 kDa de poids moléculaire, ce qui augmente par l'ajout de déchets de glucides de 7 à 8% (glycosylation).
L'activité catalytique du site actif des sous-unités est déterminée par un résidu sérine en position 200, qui se trouve dans une région «profonde» des sous-unités catalytiques.
Différentes variantes ou isoformes de l'enzyme existent dans les organismes grâce à différents endroits pour le "épissage alternatif " des messagers pré-arn à leurs deux extrémités (5 'et 3'). La séquence carboxyl-terminale de l'isoforme de chaque sous-unité est celle qui détermine l'assemblage des oligomères les uns avec les autres.
Les fonctions
L'acétylcholinestérase est une enzyme avec de multiples fonctions biologiques pas nécessairement liées les unes aux autres. Fait attesté par son expression différentielle pendant l'embryogenèse, l'extension neuronale embryonnaire, le développement musculaire et la synptogenèse.
Comme précédemment souligné, il a une fonction importante dans l'hydrolyse rapide de l'acétylcholine et donc dans la régulation de son effet sur l'espace synaptique neuromusculaire ou dans les espaces synaptiques colloriques du système nerveux central du système nerveux central.
Il peut vous servir: applications de biologie dans le bétailUn exemple de ses fonctions est la contraction du muscle squelettique, qui se produit grâce à un type de synapse chimique connue sous le nom de plaque moteur, située entre un motoneuron et une fibre musculaire.
Dans cette synapse.
Ce processus de neurotransmission est assez complexe, cependant, la participation de l'acétylcholinestérase est cruciale pour la terminaison de la transmission synaptique qui dépend du neurotransmetteur de l'acétylcholine, car il doit être dégradé puis disséminer en dehors de la fente synaptique pour accomplir l'excitation de la membrane.
Ainsi, l'enzyme de l'acétylcholinestérase est responsable de la régulation de la concentration de cet émetteur dans la synapse de Neuromotora.
D'autres fonctions «non classiques» de l'enzyme sont liées à la névritogenèse ou à la croissance des cellules nerveuses; Avec les processus d'adhésion cellulaire, la synaptogenèse, l'activation des neurones-dopamine dans la substance noire du cerveau moyen, les processus hématopoïétiques et le thrombus poétique, entre autres.
Inhibiteurs
Les inhibiteurs de l'acétylcholinestérase travaillent hydrolysés en acétylcholine, augmentant ainsi le niveau et la durée de l'action de ce neurotransmetteur. Ils peuvent être classés, selon leur mécanisme d'action, comme réversible et irréversible.
Inhibiteurs irréversibles
Ce sont ceux qui inhibent irréversiblement l'activité hydrolytique de l'acétylcholinestérase en raison de leur jonction covalente au résidu sérine au site actif de l'enzyme. Ce groupe est principalement composé d'organophosphate.
En général, ce sont des composés actifs présents dans de nombreux insecticides et sont responsables d'un grand nombre de décès accidentels dus à l'empoisonnement. Ce sont des esters ou des thioles dérivés de l'acide phosphorique, phosphonique, phosphine ou phosphoramídico.
Le sarin, le tabun, le soman et la cyclosarine sont parmi les composés les plus toxiques synthétisés par l'homme car ils peuvent tuer un être humain en induisant des défaillances respiratoires et circulatoires en raison du blocage de l'acétylcholinestérase dans le système nerveux périphérique.
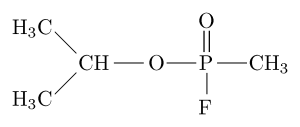 Structure moléculaire de l'inhibiteur organophosphate «Sarín» (Source: Sivizius [domaine public] via Wikimedia Commons)
Structure moléculaire de l'inhibiteur organophosphate «Sarín» (Source: Sivizius [domaine public] via Wikimedia Commons) Sarin, par exemple, est un "gaz nerveux" qui a été utilisé comme une arme chimique pour une utilisation terroriste.
Inhibiteurs réversibles
Cet ordre des groupes de classification des inhibiteurs compétitifs et non compétitifs qui fonctionnent à travers une carbamylation transitoire et réversible d'un résidu de sérine sur le site actif et beaucoup ont été synthétisés et purifiés à partir de sources de plantes ou fongiques.
Peut vous servir: Sokes: caractéristiques, structure, fonctionsLes carbamates tels que la physostigmine et la néostigmine sont des inhibiteurs réversibles qui sont utilisés comme médicaments pour le traitement de maladies telles que le glaucome et la Miastenie gravis, respectivement.
D'autres agents thérapeutiques de ce groupe sont également utilisés pour le traitement de la maladie d'Alzheimer, Parkinson de Parkinson, des obstructions intestinales postopératoires (iléus postopératoire), une distension de la vessie et comme antidotes pour une surdose avec anticholinergique.
Butirilcolinestérase
Un mécanisme naturel intéressant contre certaines substances inhibiteurs de l'acétylcholinestérase a à voir avec la participation d'une enzyme moins spécifique connue sous le nom de buttirilcolinestérase.
Cette enzyme est également capable d'hydrolyz.
Acétylcholinestérase et maladie d'Alzheimer
Il a été démontré que l'acétylcholinestérase forme un complexe stable avec les composantes des caractéristiques de Seniles de la pathologie. De plus, certains schémas modifiés de glycosylation de cette enzyme ont été liés à la présence et à la formation de plaques amyloïdes dans le cerveau.
De nombreux inhibiteurs réversibles de l'acétylcholinestérase ont donc été utilisés comme médicaments de première génération pour le traitement de cette maladie et d'autres conditions neurodégénératives apparentées. Parmi eux se trouvent Donepezilo, Rivastigmina et Galantamine.
Les références
- DVIR, H., Silman, je., Harel, m., Rosenberry, t. L., & Sussman, J. L. (2010). Acétylcholinestérase: de la structure 3D à la fonction. Interactions chimiques-biologiques, 187, 10-22.
- Houghton, P., Ren, et., & Howes, m. (2006). Inhibiteurs de l'acétylcholinestérase des plantes et des champignons. Rapports de produits naturels, 23, 181-199.
- KRSTI, D. Z., Lazarevi, t. D., Lien, un. M., & Vasi, V. M. (2013). Inhibiteurs de l'acétylcholinestérase: pharmacologie et toxicologie. Neuropharmacie actuelle, onze, 315-335.
- Mukherjee, P. K., Kumar, V., Mauvais, m., & Houchton, P. J. (2007). Inhibiteurs de l'acétylcholinestérase des plantes. Phytomédecine, 14, 289-300.
- Quinn, D. M. (1987). Acétylcholinestérase: structure enzymatique, dynamique de réaction et états de transition virtuelle. Chem. Tour., 87, 955-979.
- Ratchi, m., Mazzucchelli, m., Porrello, e., Lanni, C., & Govoni, S. (2004). Inhibiteurs de l'acétylcholinestérase: nouvelles activités de vieilles moléles. Recherche pharmacologique, cinquante, 441-451.
- Rosenberry, t. (1975). Acétylcholinestérase. Progrès de l'enzymologie et des domaines connexes de la biologie moléculaire, 43, 103-218.
- Soreq, H., & Seidman, S. (2001). Acétylcholinestérase - nouveaux rôles pour un ancien acteur. Revues naturelles, 2, 294-302.
- Contes, V. N. (2001). Acétylcholinestérase dans la maladie d'Alzheimer. Mécanismes de vieillissement et de développement, 122, 1961-1969.
- « Caractéristiques, structures et fonctions de Ribulosa
- 14 types de contrat d'emploi et leurs caractéristiques »

