Structure de l'iodure de plomb, propriétés, obtention, utilisations

- 1502
- 235
- Justine Charpentier
Il Iodure de tête Il s'agit d'un composé inorganique formé par l'élément de plomb (PB) dans son oxydation +2 et iode (i) avec Valence -1. Sa formule chimique est le PIB2. C'est un composé toxique. Parce qu'il mène nocif pour l'être humain, les animaux et les écosystèmes naturels. De plus, l'iodure peut également provoquer certaines maladies.
Le composé du PIB4, C'est, avec le plomb dans l'oxydation +4, il semble qu'il n'existe pas, probablement en raison de la capacité de réduction de l'ion iodure (i-). Le PIB2 C'est une couleur jaune un peu soluble dans l'eau.
 Diriger l'iodure (PIB2) solide. W. Oelen / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Diriger l'iodure (PIB2) solide. W. Oelen / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Il peut être obtenu en utilisant une réaction d'échange d'ions entre un sel d'iodure et un plomb qui sont tous deux solubles dans l'eau.
Il possède des propriétés semi-conductrices, de sorte que la plupart de ses applications actuelles se trouvent dans des dispositifs photovoltaïques, des détecteurs de certains rayonnements et capteurs.
L'une des utilisations les plus étudiées de ce composé est celle des cellules solaires de Perovskita, qui se sont révélées très efficaces et à faible coût.
[TOC]
Structure
Dans l'iodure de plomb, l'union entre ses atomes n'est ionique qu'en partie en partie. Les atomes forment des couches avec une structure hexagonale et ils sont liés les uns aux autres à travers des forces faibles de van der Waals.
Ces forces ne sont ni ioniques ni covalentes, sont de faibles interactions entre les couches électroniques d'atomes.
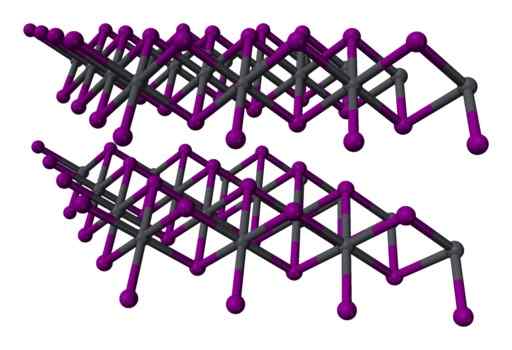 Structure à trois couches à deux couches2 cristalline. Gris = plomb; Violet = iode. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons.
Structure à trois couches à deux couches2 cristalline. Gris = plomb; Violet = iode. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons. Nomenclature
- Iodure de tête
- Iodure de tête (II)
- Diyoduro
- Iodure de plomboso
Propriétés
État physique
Solide cristallin jaune vif. Cristaux hexagonaux.
 Cristaux hexagonaux d'iodure de plomb. Alessandro e damiano / cc par (https: // CreativeCommons.Org / licences / par / 4.0). Source: Wikimedia Commons.
Cristaux hexagonaux d'iodure de plomb. Alessandro e damiano / cc par (https: // CreativeCommons.Org / licences / par / 4.0). Source: Wikimedia Commons. Poids moléculaire
461 g / mol
Point de fusion
410 ºC
Point d'ébullition
954 ° C, ébullition avec décomposition.
Densité
6,16 g / cm3
Solubilité
Soluble légèrement soluble: 0,076 g / 100 ml à 25 ° C. Eau chaude soluble. Insoluble dans l'alcool et l'acide chlorhydrique froide (HCL).
Peut vous servir: sodium: histoire, structure, propriétés, risques et utilisationsPropriétés chimiques
Ses propriétés oxydantes et réducteurs sont faibles. Cependant, vous pouvez présenter des réactions d'oxydéduction.
Bien qu'il soit très peu soluble dans l'eau se dissout dans des solutions concentrées d'iodures alcalins tels que l'iodure de potassium (KI). Il est soluble dans une solution concentrée d'acétate de sodium (ch3Poche). Il se dissout librement dans une solution de thiosulfate de sodium (Na2S2SOIT3).
Certains auteurs indiquent que dans l'eau, l'ION PBI peut être généré+ Et s'il y a un ion ion en excès (i-) des espèces plus complexes telles que le PIB peuvent être formées3- et le PIB42-, entre autres.
Ce n'est pas inflammable.
Autres propriétés physiques
Il se comporte comme un semi-conducteur, c'est-à-dire qu'il peut ou non conduisez de l'électricité en fonction des conditions auxquelles il est soumis.
Il s'agit d'un semi-conducteur de l'écart direct, c'est-à-dire que l'un de ses électrons passe de la bande de Valence à la conduite, il ne doit avoir qu'une quantité d'énergie égale à la bande passante interdite.
En raison du nombre atomique élevé de ses éléments (Pb = 82, i = 53), il a une capacité photoélectrique élevée. Sa bande de 2,5 Ever Gap permet des performances photovoltaïques à haute efficacité à des températures jusqu'à 250 ° C.
Obtention
Il peut être préparé en réagissant un composé soluble dans l'eau avec de l'acide iarhydique (HI) ou avec un iodure de métal soluble. Par exemple, une solution aqueuse d'acétate de plomb avec de l'iodure de potassium est mélangée:
PB (ch3Roucouler)2 + 2 ki → PIB2↓ + 2 K (Choisissez3Roucouler)
Ce type de réaction est connu sous le nom de «échange d'ions» parce que les cations et les anions sont échangés entre les sels.
Dans l'exemple mentionné, l'acétate de potassium est très soluble dans l'eau et reste dissous, tandis que l'iodure de potassium, étant moins soluble, précipité et filtre. La purification se fait en recristallant le composé dans l'eau.
Peut vous servir: cristallisationPBI PRÉCIPITATION2 Il peut être vu dans l'image suivante qui montre un tube à essai où le nitrate de plomb (II) (PB (non3)2) et l'iodure de potassium (Ki) en solution aqueuse. Cet effet est appelé "or d'or".
 Pluie d'or du PIB2. Stefano SCT / CC BY-S (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Pluie d'or du PIB2. Stefano SCT / CC BY-S (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Applications
Comme semi-conducteur
Il est utilisé comme détecteur pour les photons à haute énergie tels que les rayons x et les rayons gamma. Il peut être utilisé dans les dispositifs photovoltaïques, les photocells, les lumières LED, les détecteurs optiques et la classification biologique et les capteurs.
S'il est introduit dans les nanostructures, il peut être utilisé dans la photocatalyse et les cellules solaires. De plus, de nombreuses nanoparticules de PIB2 Ils ont des propriétés luminescentes.
 L'iodure de plomb est utilisé dans les détecteurs médicaux x-raffinement. Auteur: lkcjjang40090. Source: Pixabay.
L'iodure de plomb est utilisé dans les détecteurs médicaux x-raffinement. Auteur: lkcjjang40090. Source: Pixabay. Les cellules solaires
Le PIB2 Il s'agit d'un intermédiaire dans la synthèse de Perovskitas destinés aux cellules solaires. Ce type de cellules photovoltaïques contiennent du méthylammonium et de l'iodure de plomb (choisissez3NH3PIB3) Sur une base de l'oncle2.
Ces appareils ont une efficacité élevée et un faible coût, ils ont donc été beaucoup d'études et de recherche.
 Cellules solaires sur le toit d'une maison sur le terrain. Les cellules solaires dans lesquelles PBI est utilisée2 Ils sont très efficaces et ne sont pas très chers, ils pourraient donc être utilisés dans des maisons à l'avenir. Auteur: Manfred Antranias Zimmer. Source: Pixabay.
Cellules solaires sur le toit d'une maison sur le terrain. Les cellules solaires dans lesquelles PBI est utilisée2 Ils sont très efficaces et ne sont pas très chers, ils pourraient donc être utilisés dans des maisons à l'avenir. Auteur: Manfred Antranias Zimmer. Source: Pixabay. Cependant, depuis Cho3NH3PIB3 Il peut se décomposer avec l'eau de pluie, il a été étudié à quel point ces cellules peuvent être polluées lorsqu'elles sont utilisées et lorsqu'ils sont rejetés.
Le ch3NH3PIB3 Au contact de l'eau, il se divise en méthylamine (choisissez3NH2), Acide yodhydrique et PIB2. Ce dernier, bien qu'il soit peu soluble dans l'eau, au fil du temps peut libérer des quantités de l'ion toxique PB2+.
Les études ne sont pas concluantes, car le lieu où la libération de plomb se produit pour déterminer si le montant peut être nuisible à court terme. D'un autre côté, une libération continue peut bioaccumuler et être très dangereuse.
Peut vous servir: butanone: structure, propriétés et utilisationsAutres applications
- Il est semé sous forme de pulvérisation dans les nuages pour produire de la pluie.
- Dans les filtres pour l'astronomie de l'infrarouge lointain.
- En photographie, impressions, films pour enregistrer des images optiques, des émulsions photographiques.
- En revêtement de freinage. En lubrifiant les graisses.
- Lampes à arc à vapeur mercure. Sur papier électrotique.
- Matériaux thermoélectriques, batteries thermiques avec de l'iode.
Des risques
Pour la sécurité
Il doit être stocké loin des oxydants tels que des peroxydes, des peroxydes, des permanganates, des chlorises et des nitrates. Le contact avec des métaux chimiquement actifs tels que le potassium, le sodium, le magnésium et le zinc doit également être évité. Dans tous ces cas, une réaction violente peut se produire.
Si vous subissez un chauffage, les gaz toxiques de plomb et d'iode sont générés.
Pour la santé
Est très nocif pour l'être humain. Il a été confirmé qu'il est cancérogène pour les animaux, il est donc raisonnablement déduit qu'il est également pour l'être humain.
Il peut provoquer des maux de tête, une irritabilité, réduire la mémoire et perturber le sommeil. Le plomb contenu dans ce composé peut générer des dommages permanents aux reins, au cerveau, aux nerfs, aux cellules sanguines et au risque à haute pression.
Il doit être géré comme un tératogène (composé qui peut générer un défaut congénital). Il peut également produire de l'iodisme, dont les symptômes sont la congestion des narines, les maux de tête, l'irritation des muqueuses et l'éruption cutanée, entre autres.
Pour l'environnement naturel
Il est classé comme polluant toxique. Il doit être tenu à l'écart de l'eau et des sources de drainage. Pour éviter de contaminer des digues, il faut construire chaque fois qu'il est nécessaire de le conserver.
Il est très toxique pour la vie aquatique avec des effets qui durent au fil du temps, car il est bioacumulable.
Les références
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- OU.S. Bibliothèque nationale de médecine. (2019). Iodure de tête. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Evstropev; S.K. et al. (2020). Synthèse et caractérisation de PVP / PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Lien récupéré.Springer.com.
- Ismail, R.POUR. et al. (2016). Synthèse de PBI2 Nanoparticules par ablation laser dans le méthanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Lien récupéré.Springer.com.
- MATÉRIAUX. (2013). Diriger l'iodure (PIB2) Semi-conducteur. Récupéré d'Azom.com.
- CDH (2008). Plomb (ii) iodure. Matériel de fiche technique de sécurité. Récupéré de chdfinechemical.com.
- Hailegnaw, B. et al. (2015). Pluie sur les pérovskites à base d'iodure de plomb au méthylammonium: effets environnementaux possibles des cellules solaires de la pérovskite. J. Chèque. Chem. Let. 2015, 6, 9, 1543-1547. Récupéré des pubs.ACS.org.
- Fondation Wikimedia (2020). Plomb (ii) iodure. Récupéré de.Wikipédia.org.
- « Structure de l'acétate de plomb, propriétés, obtention, utilisations
- Organisation d'une entreprise objective, structure, exemple »

