Historique iode, propriétés, structure, obtention, risques, utilisations

- 3921
- 671
- Raphaël Charles
Il iode Il s'agit d'un élément non métallique réactif qui appartient au groupe 17 du tableau périodique (halogènes) et est représenté par le symbole chimique I. Essentiellement, c'est un élément bien connu au niveau populaire, de l'eau iodisée à l'hormone de la tyrosine.
À l'état solide, l'iode est gris foncé avec un lustre métallique (image inférieure), capable de sublimer pour produire une vapeur violette qui, lors de la condensation sur une surface froide, laisse un résidu sombre. Nombreux et attrayants ont été des expériences pour démontrer ces caractéristiques.
 Cristaux d'iode robustes. Source: Bungee [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Cristaux d'iode robustes. Source: Bungee [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Cet élément a été isolé pour la première fois par Bernard Curtois en 1811, tout en obtenant des composés qui servaient de matière première pour la fabrication de Saltpeter. Cependant, Curtois n'a pas identifié l'iode comme un élément, le mérite partagé par Joseph Gay-Lussac et Humphry Davy. Gay-Lussac a identifié l'élément comme "iode", un terme qui vient du mot grec "ioides" avec lequel la couleur violet a été désignée.
L'iode élémentaire, comme les autres halogènes, est une molécule diatomique, formée par deux atomes d'iode unis par une liaison covalente. L'interaction de van der Waals entre les molécules d'iode est la plus forte parmi les halogènes. Cela explique pourquoi l'iode est halogène avec les points de fusion et d'ébullition les plus élevés. De plus, c'est le moins réactif des halogènes, et celui avec moins d'électronégativité.
L'iode est un élément essentiel qui nécessite d'être ingéré, car il est nécessaire pour la croissance corporelle; le cerveau et le développement mental; Métabolisme en général, etc., recommander un apport quotidien de 110 µg / jour.
La carence de l'iode dans l'état fœtal d'une personne est associée à l'apparition du crétinisme, une condition caractérisée par le ralentissement de la croissance corporelle; ainsi que le développement mental et intellectuel insuffisant, le strabisme, etc.
Pendant ce temps, une carence en iode à tout âge de l'individu est associée à l'apparition d'un goitre, caractérisée par une hypertrophie thyroïdienne. Le goiter est une maladie endémique, car elle se limite à certaines zones géographiques avec des caractéristiques alimentaires propres.
[TOC]
Histoire
Découverte
L'iode a été découvert par le chimiste français Bernard Curtois, en 1811, alors qu'il travaillait avec son père dans la production de Salitre, nécessitant le carbonate de sodium.
Ce composé a été isolé des algues qui se sont recueillies sur la côte de la Normandie et de la Bretagne. À cette fin, les algues ont brûlé et les cendres ont été lavées à l'eau, détruisant les déchets résultants avec l'ajout d'acide sulfurique.
À une occasion, peut-être en raison d'une erreur fortuite, Curtois a ajouté un excès d'acide sulfurique et une vapeur violette s'est formée qui a cristallisé sur des surfaces froides, déposant sous forme de cristaux sombres. Curtois soupçonnait qu'il était en présence d'un nouvel élément et l'a appelé "substance X".
Les curtois ont découvert que cette substance lorsqu'elle était mélangée avec de l'ammoniac formait un solide brun (azote triacuro) qui a exploité un contact minimal.
Cependant, Curtois a eu des limites pour poursuivre ses recherches et a décidé de livrer des signes de sa substance à Charles Desormes, Nicolas Clement, Joseph Gay-Lussac et André-Marie Ampère, afin d'obtenir sa collaboration.
Émergence du nom
En novembre 1813, DeSormes et Clement rendent public la découverte de Curtois. En décembre de la même année, Gay-Lussac a déclaré que la nouvelle substance pourrait être un nouvel élément, suggérant le nom de "Iode" du mot grec "ioides", désigné pour le violet.
Sir Humphry Davy, qui a reçu une partie de l'échantillon livré à Ampère par Curtois, a fait des expériences avec l'échantillon et a remarqué une similitude avec le chlore. En décembre 1813, la Royal Society of London a participé à l'identification d'un nouvel élément.
Bien qu'un argument entre gay-lussac et davy sur l'identification de l'iode est apparu, tous deux ont reconnu que Curtois était le premier à l'avoir isolé. En 1839 Curtoi finale.
Utilisations historiques
En 1839, Louis Daguerre a donné à l'iode sa première utilisation commerciale, par invention d'une méthode pour produire des images photographiques appelées daguerréotypes, dans de fines feuilles de métal.
En 1905, le pathologiste américain David Marine, a étudié la carence en iode dans certaines maladies et a recommandé son apport.
Proprietes physiques et chimiques
Apparence
 Sublimation des cristaux d'iode. Source: Ershova Elizaveta [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Sublimation des cristaux d'iode. Source: Ershova Elizaveta [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Lustre métallique gris foncé. Quand il sublime ses vapeurs, ils sont une coloration violette (image supérieure).
Poids atomique standard
126 904 U
Numéro atomique (z)
53
Point de fusion
113,7 ºC
Point d'ébullition
184.3 ºC
Densité
Température ambiante: 4 933 g / cm3
Solubilité
Dans l'eau, il se dissout pour provoquer des solutions brunes d'une concentration de 0,03% à 20 ºC.
Cette solubilité augmente considérablement s'il existe des ions d'iodure dissous précédemment, car un équilibre entre le I est établi- et moi2 Pour former les espèces anioniques I3-, qui est résolu mieux que l'iode.
Dans des solvants organiques tels que le chloroforme, le tétrachlorure de carbone et le disulfure de carbone, l'iode se dissout en donnant une coloration violette. Il se dissout également dans des composés d'azote, comme la pyridine, la quinoline et l'ammoniac, pour former une solution brune, encore une fois.
La différence de colorations réside dans le fait que l'iode est dissous sous forme de molécules solvatées I2, ou en tant que complexes de transfert de charge; Ces derniers apparaissent lorsqu'ils traitent.
Peut vous servir: sulfure de sodium (NA2S)Odeur
Acre, irritant et caractéristique. Seuil odeur: 90 mg / m3 et seuil d'odeur irritante: 20 mg / m3.
Coefficient de partition octanol / eau
Log p = 2,49
Décomposition
Lorsqu'il est chauffé en décomposition, il émet une fumée d'iodure d'hydrogène et plusieurs composés d'iodure.
Gelée
2,27 cp à 116 ºC
Point triple
386,65 K et 121 kPa
Point critique
819 K et 11,7 MPa
Chaleur de fusion
15,52 kJ / mol
Chaleur de vaporisation
41,57 kJ / mol
Capacité calorique molaire
54.44 J / (mol · k)
La pression de vapeur
L'iode a une pression de vapeur modérée et lorsque le récipient qui contient est ouvert, il est lentement sublimé à une vapeur violette, irritant pour les yeux, le nez et la gorge.
Nombres d'oxydation
Les nombres d'oxydation de l'iode sont: -1 (I-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) et +7 (i7+). Dans tous les sels d'iodure, comme le cas du Ki, l'iode rencontre un nombre d'oxydation de -1, car nous avons l'anion i-.
L'iode acquiert des nombres d'oxydation positifs lorsqu'il est combiné avec des éléments plus électronégatifs que lui; Par exemple, dans leurs oxydes (je2SOIT5 et moi4SOIT9) ou composés interhalogénés (I-F, I-CL et I-BR).
Électronégativité
2.66 sur l'échelle Pauling
Énergie d'ionisation
Premièrement: 1.008,4 kJ / mol
Deuxième: 1.845 kJ / mol
Troisième: 3.180 kJ / mol
Conductivité thermique
0,449 w / (m · k)
Résistivité électrique
1,39 · 107 Ω · m à 0 ºC
Ordre magnétique
Diamagnétique
Réactivité
L'iode est combiné avec la plupart des métaux pour former des iodures, et aussi avec des éléments non métalliques tels que le phosphore et d'autres halogènes. L'ion iodure est un agent réducteur fort, qui libère spontanément un électron. L'oxydation de l'iodure produit un colorant brunâtre d'iode.
L'iode, au contraire de l'iodure, est un agent oxydant faible; plus faible que le brome, le chlore et le fluorure.
L'iode avec le numéro d'oxydation +1 peut être combiné avec d'autres halogènes avec le numéro d'oxydation -1, pour créer les halogénures d'iode; Par exemple: bromure d'iode. Il est également combiné avec l'hydrogène pour provoquer l'iodure d'hydrogène, qui après la dissolution dans l'eau est appelé acide iarhydique.
L'acide yodhorrique est un acide très fort capable de former des iodures par réaction avec les métaux ou leurs oxydes, hydroxydes et carbonates. L'iode a un état d'oxydation +5 dans l'acide yodium (Hio3), qui est déshydraté pour produire du pentoxyde d'iode (i2SOIT5).
Structure et configuration électroniques
- Atome d'iode et leurs liens
 Molécule diatomique d'iode. Source: Benjah-Bmm27 via Wikipedia.
Molécule diatomique d'iode. Source: Benjah-Bmm27 via Wikipedia. L'iode dans son état basal se compose d'un atome qui a sept électrons de Valencia, un seul de pouvoir compléter son octet et devenir isoléctronique avec du gaz de xénon noble. Ces sept électrons sont disposés dans leurs orbitales 5s et 5p en fonction de leur configuration électronique:
[Kr] 4ddix 5s2 5 P5
Par conséquent, les atomes je montre une forte tendance à lier de manière covalente afin que chacun ait individuellement huit électrons dans sa couche la plus à l'extérieur. Ainsi, deux atomes j'approche et forment le lien i-i, qui définit la molécule diatomique I2 (image supérieure); Unité moléculaire d'iode dans ses trois états physiques dans des conditions normales.
Dans l'image, la molécule I est observée2 représenté par un modèle de remplissage d'espace. Non seulement c'est une molécule diatomique, mais aussi homonucléaire et apolaire; Donc ses interactions intermoléculaires (i2 - Toi2) Ils sont régis par les forces de dispersion de Londres, qui sont directement proportionnelles à leur masse moléculaire et à leur taille d'atomes.
Ce lien I-I, cependant, est plus faible par rapport à celui des autres halogènes (F-F, Cl-CL et Br-Br). Ceci est dû en théorie aux pauvres chevauchement de son spo3.
- Cristaux
La masse moléculaire du i2 Il permet à ses forces dispersives d'être suffisamment directionnelles et fortes pour établir un verre ortorrombique à la pression ambiante. Sa teneur élevée en électrons fait que la lumière favorise les symphines de transition énergétique, qui produit des cristaux d'iode.
Cependant, lorsque l'iode sublime ses vapeurs présentent une coloration violet. Cela indique déjà une transition plus spécifique dans les orbitales moléculaires du i2 (Ceux qui ont une plus grande énergie ou antitienlace).
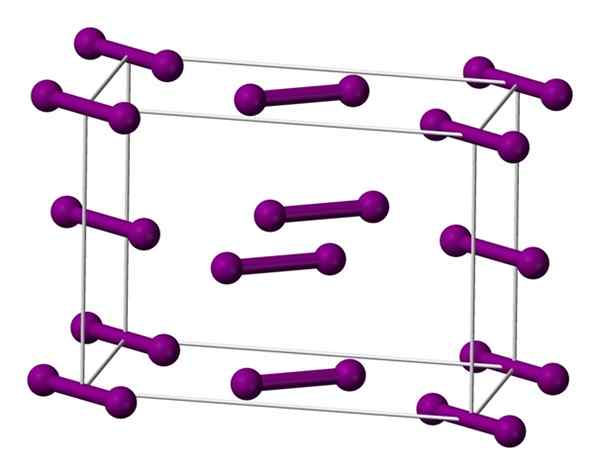 Cellule ortorrombique unitaire centrée sur la base pour le cristal d'iode. Source: Benjah-Bmm27 [domaine public].
Cellule ortorrombique unitaire centrée sur la base pour le cristal d'iode. Source: Benjah-Bmm27 [domaine public]. Les molécules je suis montrée ci-dessus2, représenté par un modèle de sphères et de barres, commandés à l'intérieur de la cellule ortorrombique.
On peut observer qu'il y a deux couches: celles de ce qui ci-dessous avec cinq molécules, et celle du milieu avec quatre. Notez qu'une molécule d'iode est située à la base de la cellule. Le cristal est construit périodiquement ces couches dans les trois dimensions.
En tournée parallèlement aux liens I-I, on constate que les orbitales d'iode se chevauchent pour générer une bande de conduite, qui revient à cet élément un semi-conducteur; Cependant, sa capacité à conduire l'électricité disparaît si la direction perpendiculaire aux couches est suivie.
Distances de liaison
Le lien I-I semble avoir été retardé; Et en fait c'est le cas, parce que la durée de son lien augmente à partir de 266 PM (État gazeux), 272 PM (État solide).
Cela peut être dû au fait que dans le gaz les molécules I2 Ils sont très éloignés, leurs forces intermoléculaires étant presque négligeables; Dans le solide, ces forces (i-i-i) deviennent tangibles, attirant les atomes d'iode de deux molécules voisines vers elles-mêmes et selon la distance intermoléculaire (ou interatomique, autrement vue).
Il peut vous servir: relation de chimie avec d'autres sciencesEnsuite, lorsque le verre d'iode sublimal, la liaison I-I se contracte en phase gazeuse, car les molécules voisines n'exercent plus la même force d'attraction (dispersive) sur son environnement. Et aussi, logiquement, la distance je2 - Toi2 augmentation.
- Phases
Il a été mentionné ci-dessus que le lien I-I est plus faible par rapport à celui des autres halogènes. En phase gazeuse à une température de 575 ºC, 1% des molécules I2 Ils se désintégrent en individu et atomes. Il y a tellement d'énergie thermique que seulement deux et re -join sont séparés, et ainsi de suite.
De même, cette rupture de liaison peut se produire si d'énormes pressions sur les cristaux d'iode sont appliquées. Lorsque vous le comprimez trop (sous pression des centaines de milliers de fois plus élevés que l'atmosphère), les molécules I2 Ils sont réorganisés en phase monoatomique I, et on dit ensuite que l'iode présente des caractéristiques métalliques.
Cependant, il existe d'autres phases cristallines, telles que: Orthrome centré sur le corps.
Où est-il et obtenez
L'iode a une proportion de poids, par rapport à la croûte terrestre, 0,46 ppm, occupant le lieu 61 en abondance. Les minéraux yoduro sont rares, et les dépôts d'iode qui sont commercialement exploitables sont des yodatos.
Les minéraux d'iode trouvent dans les roches ignées avec une concentration de 0,02 mg / kg à 1,2 mg / kg et dans les roches magmatiques avec une concentration de 0,02 mg à 1,9 mg / kg. Il peut également être trouvé dans le Kimmeridge Lutita, avec une concentration de 17 mg / kg de poids.
De plus, les minéraux d'iode se trouvent dans les roches de phosphate avec une concentration variant entre 0,8 et 130 mg / kg. L'eau de mer a une concentration d'iode qui varie de 0,1 à 18 µg / L. Les algues, les éponges et les huîtres marines étaient auparavant les principales sources d'iode.
Cependant, cependant, les principales sources sont le caliche, les dépôts de nitrate de sodium dans le désert d'Atacama (Chili) et les Salmuelas, principalement ceux du champ de gaz japonais à Minami Kanto, à l'est de Tokyo, et le bassin du champ d'Anadarko en Oklahoma (USA (USA ).
Le caliche
L'iode est extrait de l'iodinus caliche et est traité avec du bisulfite de sodium pour le réduire à l'iodure. Ensuite, la solution réagit avec Yodato nouvellement extrait pour faciliter sa filtration. Le caliche était la principale source d'iode au XIXe et au début du XXe siècle.
La saumure
Après sa purification, la saumure est traitée avec de l'acide sulfurique, qui produit de l'iodure.
Cette solution d'iodure réagit par la suite avec le chlore pour produire une solution d'iode diluée, qui s'évapore au moyen d'un courant d'air dévié à une tour absorbante de dioxyde de soufre, produisant la réaction suivante:
Toi2 + 2 h2Ou + donc2 => 2 Hi + H2Swin4
Par la suite, l'iodure d'hydrogène réagit avec le chlore pour libérer de l'iode dans un état gazeux:
2 Hi + Cl2 => I2 + 2 HCl
Et enfin, l'iode filtre, purifie et emballage pour une utilisation.
Papier biologique
- Régime recommandé
L'iode est un élément essentiel, car il intervient dans de nombreuses fonctions dans les êtres vivants, qui sont particulièrement connus chez l'homme. La seule façon d'entrée d'iode à l'homme est les aliments qu'il ingère.
Le régime d'iode recommandé varie avec l'âge. Ainsi, un garçon à 6 mois nécessite une consommation de 110 µg / jour; Mais à partir de l'âge de 14 ans, le régime recommandé est de 150 µg / jour. De plus, il est à noter que l'apport en iode ne doit pas dépasser 1.100 µg / jour.
- Les hormones thyroïdiennes
L'hormone stimulante thyroïdienne (TSH) est sécrétée par l'hypophyse et stimule l'iode avec des follicules thyroïdiens. L'iode est transporté à l'intérieur des follicules thyroïdiens, appelés colloïdes, où il se lie à la tyrosine d'acide aminé pour former la monoyodothyrosine et la diiodothyrosine.
Dans le colloïde folliculaire, une monoyodirosine3). D'un autre côté, deux molécules de diiodothyrosine peuvent être jointes, formant du tétrarydotyron (t4). Le T3 et T4 Ce sont les hormones thyroïdiennes tellement appelées.
Hormones t3 et T4 Ils sont sécrétés au plasma où ils se lient aux protéines plasmatiques; Parmi eux, la protéine de convoyeur des hormones thyroïdiennes (TBG). La plupart des hormones thyroïdiennes sont transportées dans le plasma comme t4.
Cependant, la forme active des hormones thyroïdiennes est t3, Alors le T4 Dans les "organes blancs" des hormones thyroïdiennes, expériences et se transforment en t3 Pour exercer votre action hormonale.
Effets
Les effets de l'action des hormones thyroïdiennes sont multiples, étant capables de souligner ce qui suit: Augmentation du métabolisme et de la synthèse des protéines; promotion de la croissance corporelle et du développement du cerveau; Augmentation de la pression artérielle et de la fréquence cardiaque, etc.
- Carence
La carence en iode et, par conséquent, des hormones thyroïdiennes, connues sous le nom d'hypothyroïdie, a de nombreuses conséquences qui sont influencées par l'âge de la personne.
Si une carence en iode se produit pendant l'état fœtal d'une personne, la conséquence la plus pertinente est le crétinisme. Cette condition se caractérise par des signes tels que la détérioration de la fonction mentale, le retard dans le développement physique, le strudisme et la maturation sexuelle tardive.
Peut vous servir: cuivre: histoire, propriétés, structure, utilisations, papier biologiqueUne carence en iode peut induire un goitre, quel que soit l'âge auquel une carence se produit. Un goiter est un développement thyroïdien excessif, causé par une stimulation excessive de la glande par l'hormone TSH, libérée de l'hypophyse en raison d'une carence en iode.
La taille excessive de la thyroïde (goiter) peut compresser la trachée, limitant le passage de l'air à travers elle. De plus, cela peut endommager les nerfs laryngés qui peuvent avoir un rhum en conséquence.
Des risques
Une intoxication due à une consommation excessive d'iode peut provoquer des brûlures dans la bouche, la gorge et la fièvre. Aussi douleurs abdominales, nausées, vomissements, diarrhée, impulsion faible et coma.
Un excès d'iode produit certains des symptômes observés dans une carence: il y a une inhibition de la synthèse des hormones thyroïdiennes, donc la libération de TSH augmente, ce qui entraîne une hypertrophie thyroïdienne; c'est-à-dire un goiter.
Il y a des études qui indiquent qu'un apport excessif en iode peut provoquer un cancer papillaire thyroïdien. De plus, une consommation excessive d'iode peut interagir avec les médicaments en limitant son action.
L'apport excessif en iode avec des médicaments antithyroïdiens, tels que le métiazole, utilisé pour traiter l'hyperthyroïdie, peut avoir un effet additif et provoquer une hypothyroïdie.
Les inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), tels que le benazépril, sont utilisés dans le traitement de l'hypertension. Prendre une quantité excessive d'iodure de potassium augmente le risque d'hypercalimie et d'hypertension.
Applications
Médecins
L'iode agit comme un désinfectant de la peau ou des blessures. Il a presque une action antimicrobienne d'instant.
Il exerce son action antivirale fondamentalement sur les virus couverts, postulant qui attaque la surface des virus couverts.
L'iodure de potassium en solution concentrée est utilisé dans le traitement de la thyrotoxicose. Il est également utilisé pour contrôler les effets d'un rayonnement de 131I lors du blocage de l'union de l'isotope radioactif à la thyroïde.
L'iode est utilisé dans le traitement de la kératite dendritique. Pour cela, la cornée aux vapeurs de l'eau saturée avec de l'iode est exposée, l'épithélium de la cornée perd temporairement; Mais il y a une récupération complète en deux ou trois jours.
L'iode a également des effets bénéfiques sur le traitement de la fibrose des sinus humains. De même, il a été souligné que le 131Je pourrais être un traitement contre le cancer de la thyroïde en option.
Réactions et action catalytique
L'iode est utilisé pour détecter la présence d'amidon, donnant une coloration bleue. La réaction de l'iode avec l'amidon est également utilisée pour détecter la présence de faux billets imprimés sur du papier contenant de l'amidon.
Le tétrayodomercurate de potassium (II), également connu sous le nom de réactif Nessler, est utilisé dans la détection d'ammoniac. De même, une solution d'iode alcaline est utilisée dans le test d'iodoforme, pour montrer la présence de méthylcetones.
Iodure inorganique. À un stade du processus, des tétrayoduros de ces métaux doivent être formés.
L'iode sert de stabilisateur pour la colfonie, l'huile et d'autres produits en bois.
L'iode est utilisé comme catalyseur dans les réactions de synthèse organique de la méthylation, de l'isomérisation et de la déshydrogénation. Pendant ce temps, l'acide iarchlorique est utilisé comme catalyseur pour la production d'acide acétique dans les processus de Monsanto et Cativa.
L'iode agit comme un catalyseur dans la condensation et l'alpose des amines aromatiques, ainsi que dans les processus de sulfatisation et de sulfanation, et pour la production de caoutchoucs synthétiques.
Photographie et optique
Silver Yoduro est un élément essentiel du film photographique traditionnel. L'iode est utilisé dans la fabrication d'instruments électroniques tels que des prismes de verre uniques, des instruments optiques polarisants et un verre capable de transmettre des rayons infrarouges.
Autres utilisations
L'iode est utilisé dans l'élaboration des pesticides, de l'aniline et des colorants phtaleína. De plus, il est utilisé dans la synthèse des colorants et est un agent d'extinction de fumée. Et enfin, l'iodure d'argent sert de noyau de condensation de vapeur d'eau dans les nuages, afin de provoquer la pluie.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Stuart Ira Fox. (2003). Physiologie humaine. Première édition. Modifier. McGraw-Hill Inter-American
- Wikipédia. (2019). Iode. Récupéré de: dans.Wikipédia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi et Onoda Mitsuko. (2003). Structure modulée de l'iode solide pendant la dissociation moléculaire STI. Volume de la nature 423, pages971-974. est ce que je.org / 10.1038 / Nature01724
- Chen L. et al. (1994). Transitions de phase structurelle de l'iode à haute pression. Institut de physique, Sinica Academy, Pékin. est ce que je.org / 10.1088 / 0256-307X / 11/2/010
- Stefan Schneider et Karl Chatte. (26 août 2019). Iode. Encyclopædia Britannica. Récupéré de: Britannica.com
- Docteur. Doug Stewart. (2019). Faits d'élément d'iode. Chimicool. Récupéré de: Chemicool.com
- Centre national d'information sur la biotechnologie. (2019). Iode. Base de données PubChem. CID = 807. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Rohner, F., Zimmermann, m., Jooste, P., Pandav, c., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarqueurs de la nutrition pour le développement-iode revue. The Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945 / JN.113.181974
- Advameg. (2019). Iode. Chimie expliquée. Récupéré de: chimie-explayée.com
- Traci Pedersen. (19 avril 2017). Faits sur l'iode. Récupéré de: LiveScience.com
- Megan Ware, rdn, ld. (30 mai 2017). Tout ce que vous devez savoir sur l'iode. Récupéré de: MedicalNewstody.com
- Institut national de la santé. (9 juillet 2019). Iode. Récupéré de: SDG.Dyerne.NIH.Gouvernement
- « HISTOIRE DE KRIPTON, propriétés, structure, obtention, risques, utilisations
- Antécédents de Mary Celeste, événements, théories »

