Oxyde de soufre
- 1404
- 251
- Adam Mercier
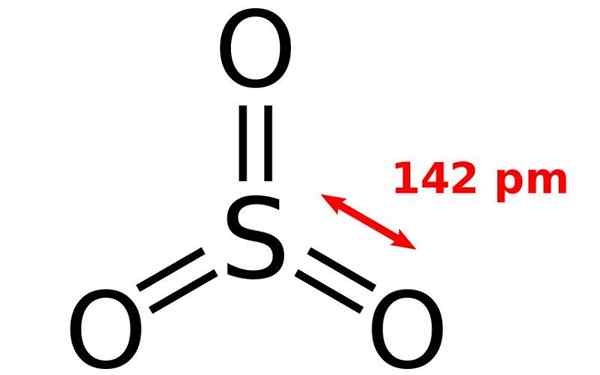
 Structure chimique de la molécule d'oxyde de soufre. Source: Joel Holdsworth, Wikimedia Commons
Structure chimique de la molécule d'oxyde de soufre. Source: Joel Holdsworth, Wikimedia Commons Qu'est-ce que l'oxyde de soufre?
Il oxyde de soufre (Vi), également connu sous le nom de trioxyde de soufre ou d'anhydride sulfurique, est un composé chimique de la formule S3, Que, dans des conditions normales, c'est un solide incolore et fibreux, et à 25 ° C et 1 atm est un puissant agent polluant, responsable des pluies acides.
Le trioxyde de soufre est produit par l'oxydation de l'oxyde de soufre.
Jusqu'à présent, cependant, la seule préparation du trioxyde de soufre pur à partir de gaz contenant3 dilué, il s'agit d'un processus à une échelle de plante pilote qui implique une condensation cryoscopique.
La procédure habituelle implique plutôt la distillation pétrolière. La chaleur requise pour la distillation pétrolière est fournie plus pratique par le gaz de contact chaud de la plante d'acide sulfurique associée.
Il peut être préparé en laboratoire en chauffant à fumer de l'acide sulfurique et en collectant sublimé dans un récepteur refroidi. Si la vapeur est condensée au-dessus de 27 ° C, la forme gamma est obtenue sous forme de liquide.
Si la vapeur est condensée en dessous de 27 ° C et en présence d'une ligne d'humidité, un mélange des trois formes est obtenu. Les 3 formes peuvent être séparées par distillation fractionnaire.
La combustion de combustibles fossiles est la cause de son apparence dans l'atmosphère, ce qui est la principale cause anthropique.
Propriétés physiques et chimiques de l'oxyde de soufre
- Le trioxyde de soufre a la forme d'aiguilles blanches qui deviennent de la fumée dans l'air. Vous rencontrez souvent des inhibiteurs pour éviter la polymérisation.
Peut vous servir: Renio: découverte, propriétés, structure, utilisations- Son poids moléculaire est de 80 066 g / mol, sa densité est de 1,92 g / cm³ g / ml et les points de fusion et d'ébullition sont respectivement de 16,8 ° C et 44,7 ° C, respectivement.
- Le composé est combiné avec de l'eau avec une force explosive, formant de l'acide sulfurique en raison de son acidité. Trioxyde de soufre carboniza substances organiques.
- Le trioxyde de soufre absorbe rapidement l'humidité, émettant des fumées blanches denses. Les solutions de trioxyde d'acide sulfurique sont appelées l'acide ou l'huile sulfurique.
- La réaction du trioxyde de soufre et le diffluorure d'oxygène sont très vigoureux et des explosions sont produites si la réaction est effectuée en l'absence de solvant.
- L'excès de réaction de trioxyde de soufre avec le tétrafluoroéthylène provoque la décomposition explosive du fluorure carbonyle et du dioxyde de soufre.
- La réaction de l'acide perchlorique anhydre avec le trioxyde de soufre est violente et s'accompagne de l'évolution d'une chaleur considérable. Le trioxyde de soufre liquide réagit violemment avec le chlorure de nitrile, même 75 ° C.
- La réaction du trioxyde de soufre et l'oxyde de plomb provoque une luminescence blanche. La combinaison du trioxyde d'iode, de pyridine, de soufre et de formamide a développé un gaz sur la pressurisation après plusieurs mois.
Cela est dû à la formation lente de l'acide sulfurique, de l'eau externe ou de la déshydratation du formamide de cyanure d'hydrogène.
Des risques
Le trioxyde de soufre est un composé stable, incompatible avec des matières organiques, des métaux finement en poudre, des bases, de l'eau, des cyanures et une grande variété d'autres produits chimiques.
La substance est un fort oxydant et réagit violemment avec les matériaux combustibles et les organisateurs et les composés organiques qui provoquent un danger d'incendie et d'explosion.
Peut vous servir: oxalate de sodium (NA2C2O4): Structure, propriétés, utilisations, risquesRéagit violemment avec de l'eau humide et de l'air pour produire de l'acide sulfurique. La solution dans l'eau est un acide fort, il réagit violemment avec les bases et les métaux corrosifs, formant un gaz inflammable / explosif.
Le composé est corrosif pour les métaux et les tissus. Provoque des brûlures dans les yeux et la peau. L'ingestion provoque de graves brûlures dans la bouche, l'œsophage et l'estomac. La vapeur est très toxique par inhalation.
En cas de contact visuel, vous devez vérifier si les lentilles de contact sont utilisées et les retirer immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. L'eau froide peut être utilisée, sans appliquer une pommade oculaire.
Si le produit chimique entre en contact avec les vêtements, conservez-le le plus rapidement possible, en protégeant ses propres mains et son corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule dans la peau exposée de la victime, comme les mains, la peau contaminée par de l'eau courante et du savon non abrasif est doucement lavée et soigneusement. L'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Laver les vêtements contaminés avant de l'utiliser à nouveau.
En cas d'inhalation, la victime devrait être autorisée à se tenir dans une zone bien ventilée. Si l'inhalation est grave, la victime doit être évacuée dans une zone sûre dès que possible. Vêtements serrés en vrac, comme le cou de chemise, les ceintures ou la cravate.
Si la victime est difficile à respirer, l'oxygène doit être administré. Si la victime ne respire pas, une réanimation buccale est faite. Compte tenu toujours de prendre en compte que cela peut être dangereux pour la personne qui fournit une aide à la réanimation bouche à bouche lorsque le matériau inhalé est toxique, infectieux ou corrosif.
Il peut vous servir: acide hypophysaire (H3PO2): propriétés, utilisations et réactifsDans tous les cas, des soins médicaux immédiats doivent être recherchés.
D'un autre côté, la pollution atmosphérique due aux oxydes de soufre est un problème environnemental important, avec des millions de tonnes de dioxyde de soufre et de trioxyde émis dans l'atmosphère chaque année. Ces composés sont nocifs pour la vie végétale et animale, ainsi que pour de nombreux matériaux de construction.
Un autre gros problème à considérer est les pluies acides. Les deux oxydes de soufre se dissolvent dans les gouttes d'eau atmosphérique pour former des solutions acides, ce qui peut être très nocif lorsqu'ils tombent sous forme de pluie.
Les pluies acides peuvent endommager les forêts et faire mourir les poissons dans de nombreux lacs. Il est également corrosif pour les métaux, le calcaire et d'autres matériaux. Les solutions possibles à ce problème sont coûteuses en raison de la difficulté d'éliminer le soufre du charbon et du pétrole avant de brûler.
Applications
- Le trioxyde de soufre est un réactif essentiel des réactions de sulfonation. Ces processus fournissent des détergents, des colorants et des produits pharmaceutiques. Il est généré in situ à partir de l'acide sulfurique ou utilisé comme solution d'acide sulfurique fumant.
- Ses propriétés désinfectantes sont responsables des siècles à utiliser pour désinfecter les cubes de vin, brûlant du soufre à l'intérieur.
Les références
- Trioxyde de soufre. Récupéré d'EBI.CA.ROYAUME-UNI
- Fiche de données de sécurité Trioxyde de soufre. Récupéré de Sciencelab.com

