Histoire du tungstène, propriétés, structure, utilisations

- 3611
- 256
- Adrien Remy
Il tungstène, Wolframio ou Volframium est un métal de transition lourd dont le symbole chimique est w. Il est situé dans la période 6 avec le groupe 6 du tableau périodique, et son numéro atomique est de 74. Son nom a deux significations étymologiques: la pierre dure et la mousse de loup; Le second est parce que ce métal est également connu sous le nom de Wolframio.
C'est un métal gris argenté et, même s'il est fragile, a une grande dureté, de la densité et des points de fusion et d'ébullition élevés. Par conséquent, il a été utilisé dans toutes les applications qui impliquent des températures, des pressions ou des forces mécaniques élevées, telles que des exercices, des projectiles ou des filaments émettrices de rayonnement.
 Barre de tungstène avec sa surface partiellement oxydée. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
Barre de tungstène avec sa surface partiellement oxydée. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] L'utilisation la plus connue pour ce métal, à une culture et un niveau populaire, se trouve dans les filaments des ampoules électriques. Qui les a manipulés réalisera à quel point ils sont fragiles; Cependant, ils ne sont pas faits de tungstène pur, qui est malléable et ductile. De plus, dans des matrices métalliques telles que les alliages, il offre une excellente résistance et dureté.
Il est caractérisé et distingué par le métal avec le point de fusion le plus élevé, et pour être également plus dense que le même plomb, dépassé uniquement par d'autres métaux tels que l'osmium et l'iridium. C'est aussi le métal le plus lourd connu pour rencontrer un rôle biologique dans le corps.
Dans la plupart de ses composés ioniques, l'anion tungstate participe, wo42-, qui peut polymériser pour provoquer des grappes dans un milieu acide. D'un autre côté, le tungstène peut former des composés intermétalliques ou stériser avec des métaux ou des sels inorganiques afin que leurs solides acquièrent différentes formes ou cohérences.
Ce n'est pas très abondant dans le cortex terrestre, en ayant une tonne de seulement 1,5 gramme de ce métal. De plus, comme il s'agit d'un élément lourd, son origine est intergalactique; Spécifiquement des explosions des supernovas, qui devaient jeter des «jets» d'atomes de tungstène sur notre planète pendant leur formation.
[TOC]
Histoire
Étymologie
L'histoire du tungstène ou du wolframio a deux visages ainsi que leurs noms: l'un suisse et l'autre allemand. Dans les années 1600, dans les régions actuellement occupées par l'Allemagne et l'Autriche, les mineurs ont travaillé sur des extractions de cuivre et d'étain pour produire des bronzes.
À ce moment-là, les mineurs ont rencontré une épine dans le processus: il y avait un minéral extrêmement difficile; Le minéral était composé de Wolframite, (Faith, Mn, Mg) wo4, qui a conservé ou "dévoré" l'étain comme s'il s'agissait d'un loup.
D'où l'étymologie de cet élément, «loup» du loup en espagnol, un loup qui a mangé de l'étain; et «Ram» de mousse ou de crème, dont les cristaux ressemblaient à une longue fourrure noire. C'était ainsi que le nom «Wolfram» ou «Wolframio» est apparu en l'honneur de ces premières observations.
En 1758, du côté suisse d'un minéral similaire, le Scheelita, Cawo4, Il a été nommé «Tung Sten», ce qui signifie «pierre dure».
Les deux noms, Wolframio et Tungsten, sont largement utilisés de manière interchangeable, selon la culture. En Espagne, par exemple, et dans l'Occident européen, ce métal est davantage connu de Wolframio; tandis que sur le continent américain, le nom du tungstène prédomine.
Reconnaissance et découverte
Il était alors connu que, entre les XVIIe et XVIIIe siècles, il y avait deux minéraux: le Wolframite et le Scheelita. Mais qui a aperçu qu'il y avait un métal différent des autres? Ils ne pouvaient être caractérisés que comme des minéraux, et c'est en 1779 que le chimiste irlandais Peter Woulfe a soigneusement analysé le Wolframite et déduit l'existence de Wolframium.
Il peut vous servir: acide perbromique (HBRO4): propriétés, risques et utilisationsDu côté suisse, encore une fois, Carl Wilhelm Scheele en 1781 a pu isoler le tungstène comme wo3; Et encore plus, il a obtenu l'acide tumatique (ou wolphramique), h2Wo4 et autres composés.
Cependant, cela n'a pas été suffisant pour atteindre le métal pur, car il était nécessaire de réduire cet acide; Autrement dit, soumettez-le à un tel processus qui ne parviendra pas à l'oxygène et à cristalliser comme du métal. Carl Wilhelm Scheele n'avait pas la méthodologie appropriée pour cette réaction de réduction chimique.
C'est là que les frères espagnols d'Aluyar, Fausto et Juan José, qui ont réduit les deux minéraux (Wolframite et Scheelita) avec du charbon, dans la ville de Bergara, dans la ville de Bergara. Deux sont accordés le mérite et l'honneur d'être les découvreurs du wolframium ou du tungstène métallique (W).
Aciers et ampoules
 Toute ampoule de filament de tungstène. Source: pxhere.
Toute ampoule de filament de tungstène. Source: pxhere. Comme d'autres métaux, ses utilisations définissent son histoire. Parmi les plus importants à la fin du XIXe siècle, il y avait les alliages en acier-tungstène et les filaments de tungstène pour remplacer le carbone à l'intérieur des ampoules électriques. On peut dire que les premières ampoules, telles que nous les connaissons, ont été commercialisées en 1903-1904.
Propriétés
Apparence physique
C'est un métal gris argenté et brillant. Fragile mais d'une grande dureté (pas confuse avec la ténacité). Si la pièce est de haute pureté, elle devient malléable et dure, à la fois ou plus et plusieurs aciers.
Numéro atomique
74.
Masse molaire
183,85 g / mol.
Point de fusion
3422ºC.
Point d'ébullition
5930ºC.
Densité
19,3 g / ml.
Chaleur de fusion
52,31 kJ / mol.
Chaleur de vaporisation
774 kJ / mol.
Capacité thermique molaire
24,27 kJ / mol.
Moh dureté
7.5.
Électronégativité
2,36 sur l'échelle Pauling.
Radio atomique
139h
Résistivité électrique
52.8 nΩ · m à 20 ° C.
Isotopes
Il présente principalement de la nature comme cinq isotopes: 182W, 183W, 184W, 186Baguette magique 180W. Selon la masse molaire de 183 g / mol, qui fait en moyenne les masses atomiques de ces isotopes (et les trente autres radio-isotopes), chaque atome de tungstène ou de wolframium a environ cent dix neutrons (74 + 110 = 184).
Chimie
C'est un métal de corrosion très résistant, comme sa fine couche de WO3 le protège contre l'attaque de l'oxygène, de l'acide et des alcalis. Une fois dissous et précipités avec d'autres réactifs, leurs sels sont obtenus, qui sont appelés wolframates ou tungstates; En eux le tungstène a un état d'oxydation de +6 (en supposant qu'il y a des cations w6+).
Regroupement acide
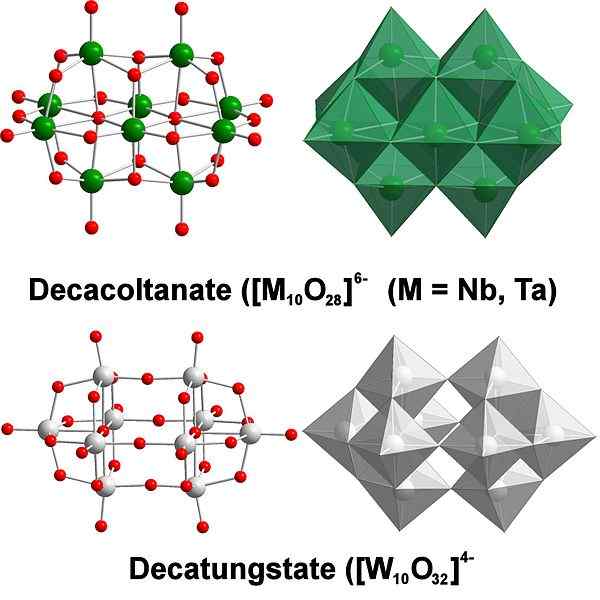 Decatungstate, un exemple de polyaxométal de tungstène. Source: Scifanz [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Decatungstate, un exemple de polyaxométal de tungstène. Source: Scifanz [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Chimiquement le tungstène est assez particulier car ses ions ont tendance à être regroupés (regroupement en anglais) pour former des hétéropolycides ou une polyaxométalate. Qui sont? Ce sont des groupes ou des grappes d'atomes qui se lient à définir un corps à trois dimensions; principalement, une avec une structure de cage sphérique, dans laquelle ils "enferment" un autre atome.
Tout commence à partir de l'anion tungstate, wo42-, Qui en milieu acide est protoned (HWO4-) et lié à un anion voisin pour former [w2SOIT7(OH)2]]2-; Et cela rejoint à son tour un autre [W2SOIT7(OH)2]]2- Pour créer le [w4SOIT12(OH)4]]4-. Donc, jusqu'à ce que en solution il y a plusieurs polytungstates.
Peut vous servir: chlorure de lithium (licl): propriétés, risques et utilisationsParathungstate a et b, [w7SOIT24]]6- et h2W12SOIT42dix-, respectivement, ils sont l'un des plus remarquables de ces polyades.
Il peut devenir un défi de considérer ses croquis et ses structures Lewis; Mais il suffit en principe de les visualiser comme des ensembles d'octaède6 (image supérieure).
Notez que ces octaèdres grisâtres finissent par définir Decatungstate, un Politungstate; Si un hétéroátomo se verrouille à l'intérieur (par exemple, le phosphore), ce serait alors un polyaxométal.
Structure et configuration électroniques
Phases cristallines
Les atomes de tungstène définissent une structure cubique centrée avec le corps (BCC, par Cubique centré sur le corps). Cette forme cristalline est connue sous le nom de phase α; Tandis que la phase β est également cubique, mais un peu dense. Les deux phases ou les formes cristallines, α et β, peuvent coexister en équilibre dans des conditions normales.
Les grains cristallins de la phase α sont isométriques, tandis que ceux de la phase β ressemblent à des colonnes. Quelle que soit la façon dont le verre est, dans ce gouvernement. Sinon, les points de fusion et d'ébullition élevés ne pouvaient pas être expliqués, ni la dureté et la densité élevées du tungstène.
Lien métallique
Les atomes de tungstène doivent être très unis. Pour augmenter une conjecture, la configuration électronique de ce métal doit être observée avant:
[XE] 4F145 D46s2
Les orbitales 5D sont très grandes et floues, ce qui impliquerait qu'entre deux atomes de fermeture w il y a des chevauchements orbitaux efficaces. De plus, les orbitales 6 contribuent aux bandes résultantes, mais dans une moindre mesure. Tandis que les orbitales 4F ont "très profondément" et que leur contribution au lien métallique est plus faible.
Ceci, la taille des atomes et les grains cristallins, sont les variables qui déterminent la dureté du tungstène et sa densité.
États d'oxydation
Dans le wolframium tungstène ou métallique, les atomes ont un état d'oxydation zéro (w0). Le retour à la configuration électronique, les orbitales 5D et 6S peuvent "vider" les électrons en fonction si W est en compagnie d'atomes très électronégatifs, comme l'oxygène ou le fluor.
Lorsque les deux électrons 6s sont perdus, le tungstène a un état d'oxydation +2 (w2+), Ce qui génère son contrat atome.
Si vous perdez également tous les électrons de vos orbitales 5D, votre statut d'oxydation deviendra +6 (W6+)); De là, il ne peut pas devenir plus positif (en théorie), car les orbitales 4F pour être internes nécessiteraient de grandes énergies pour éliminer leurs électrons. C'est-à-dire que l'état d'oxydation le plus positif est +6, où le tungstène a encore petit.
Ce tungstène (VI) est très stable dans des conditions acides ou dans de nombreux composés oxygénés ou halogénés. D'autres états d'oxydation positifs et possibles sont: +1, +2, +3, +4, +5 et +6.
Le tungstène peut également gagner des électrons s'ils sont combinés avec moins d'atomes électronégatifs que lui. Dans ce cas, leurs atomes deviennent plus grands. Il peut gagner un maximum de quatre électrons; c'est-à-dire avoir un état d'oxydation de -4 (w4-).
Obtention
Auparavant, il a été mentionné que le tungstène se trouve dans les minéraux de Wolframite et Scheelita. Selon le processus, deux composés en sont obtenus: oxyde de tungstène, wo3, ou ammonium paratungstate, (NH4)dix(H2W12SOIT42) · 4h2O (ou ATP). Chacun d'entre eux deux peut être réduit en w métallique avec du charbon au-dessus de 1050 ° C.
Il peut vous servir: Raault Law: Principe and Formula, Exemples, exercicesCe n'est pas économiquement rentable. C'est pourquoi il est préféré le produire sous forme de poussière pour traiter une fois avec d'autres métaux pour obtenir des alliages.
Il convient de mentionner que le monde chinois est le pays avec la plus grande production de tungstène. Et sur le continent américain, le Canada, la Bolivie et le Brésil, ils occupent également la liste des plus grands producteurs de ce métal.
Applications
 Un composé en carbure de tungstène: un exemple de la façon dont la dureté de ce métal peut être utilisée pour immortaliser et durcir les matériaux. Source: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Un composé en carbure de tungstène: un exemple de la façon dont la dureté de ce métal peut être utilisée pour immortaliser et durcir les matériaux. Source: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Certaines des utilisations connues de ce métal sont mentionnées ci-dessous:
-Ses sels ont été utilisés pour colorer les cotons de vieille tenue de théâtres.
-Combiné avec l'acier, il durcit encore plus, même en mesure de résister aux coupes mécaniques à haute vitesse.
-Les filaments de frittage en tungstène sont utilisés depuis plus de cent ans dans des ampoules électriques et des lampes halogénées. De plus, en raison de son point de fusion élevé, il a servi de matériau pour les tubes à rayons cathodiques et pour les buses de moteurs de fusée.
-Remplace le plomb dans la fabrication de projectiles et de boucliers radioactifs.
-Les nanocables en tungstène peuvent être utilisés dans le pH-sensible nanodispositif.
-Les catalyseurs en tungstène ont été utilisés pour faire face à la production de soufre dans l'industrie pétrolière.
-Le carbure de tungstène provient de tous ses composés qui couvrent plus d'utilisations. Du renforcement des coupes et des outils de forage, ou la fabrication de pièces armées militaires, pour mécaniser le bois, les plastiques et la céramique.
Risques et précautions
Biologique
Étant un métal relativement rare dans la croûte terrestre, ses effets négatifs sont rares. Dans les sols acides, les polytungstates peuvent ne pas affecter les enzymes utilisées par les molybdates; Mais dans les sols de base, le WO42- Il intervient (positivement ou négativement) dans les processus métaboliques du moo42- et cuivre.
Les plantes, par exemple, peuvent absorber les composés solubles du tungstène, et en les mangeant d'un animal, puis après avoir consommé leur viande, les atomes W entrent dans nos organismes. La plupart sont expulsés dans l'urine et les excréments, et on sait peu de choses ce qui arrive au reste d'entre eux.
Des études animales ont montré que lorsque des concentrations élevées de poudre de tungstène développent des symptômes similaires au cancer du poumon.
Par ingestion, un humain adulte devrait boire des milliers de gallons d'eau enrichis de sels de tungstène pour montrer une inhibition appréciable des enzymes de colinestase et de phosphatase.
Physique
En termes généraux, le tungstène est un petit élément toxique, et il y a donc peu de risques hôtes pour les dommages causés par la santé.
En ce qui concerne le tungstène métallique, vous devez éviter de respirer sa poussière; Et si l'échantillon est solide, il faut tenir compte du fait qu'il est très dense et qu'il peut causer des dommages physiques s'il tombe ou frappe d'autres surfaces.
Les références
- Bell Terence. (s.F.). Tungsten (Wolfram): propriétés, production, applications et alliages. L'équilibre. Récupéré de: the balance.com
- Wikipédia. (2019). Tungstène. Récupéré de: dans.Wikipédia.org
- Lentech b.V. (2019). Tungstène. Récupéré de: lentech.com
- Jeff Desjardins. (1er mai 2017). L'histoire du tungstène, le métal naturel le plus fort sur Terre. Récupéré de: VisualCapitaliste.com
- Doug Stewart. (2019). Faits d'élément de tungstène. Récupéré de: Chemicool.com
- Art Fisher et Pam Powell. (s.F.). Tungstène. Université du Nevada. Récupéré de: unce.A R.Édu
- Helmestine, Anne Marie, Ph.D. (2 mars 2019). Faits de tungstène ou de wolfram. Récupéré de: Thoughtco.com

