Tachement des spores
- 2683
- 339
- Eva Henry
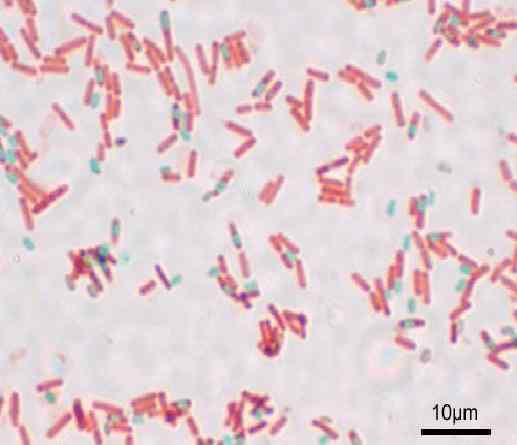
 Talage des spores par la méthode Shaeffer-Fulton ou Wirtz-Conklin. Source: Y Aussi (Uploader d'origine) [GFDL (http: // www.gnou.Org / copyleft / fdl.html) ou cc-be-sa-3.0, Wikimedia Commons
Talage des spores par la méthode Shaeffer-Fulton ou Wirtz-Conklin. Source: Y Aussi (Uploader d'origine) [GFDL (http: // www.gnou.Org / copyleft / fdl.html) ou cc-be-sa-3.0, Wikimedia Commons Quelle est la coloration des spores?
La Tachement des spores C'est la méthodologie utilisée pour colorer les structures de résistance qui forment certains genres bactériens lorsqu'ils sont dans des conditions défavorables. Il sert à identifier les bactéries.
Il existe de nombreux genres qui forment des spores, cependant, les principaux sont Bacille et Clostridium. Ces genres sont considérés comme plus pertinents car ils ont des espèces pathogènes pour l'être humain.
Chaque bacille peut donner naissance à une spore. Au moment de la teinture de la préparation, les spores se trouvent à l'intérieur du Bacillus (Endospora) ou à l'extérieur de ceci (Exospora). Avec des techniques de coloration conventionnelles pour les bactéries - comme la coloration de Gram - les spores sont incolores.
À l'heure actuelle, il existe plusieurs méthodologies de coloration capables de traverser la structure épaisse de la spore pour la teindre. Ces méthodologies sont très variées et la technique de Dorner, la coloration de Möller et la méthodologie Shaeffer-Fulton, également connue sous le nom de Wirtz-Conklin, peuvent être mentionnées.
De toutes les techniques mentionnées, la méthodologie de Shaeffer-Fulton est la plus utilisée dans les laboratoires de routine. Doit son nom à deux microbiologistes qui ont créé la coloration en 1930: Alicia Shaeffer et MacDonald Fulton. Cependant, parfois la technique est appelée Wirtz-Conklin en l'honneur de deux bactériologistes de 1900.
Base
Les spores ne sont pas teintes avec des colorations conventionnelles car elles ont un mur très épais. La composition complexe des spores empêche l'entrée de la plupart des colorants.
Si la spore de l'extérieur est étudiée vers l'intérieur, les couches suivantes sont observées: d'abord, il y a l'exosporium, qui est la couche la plus belle et la plus externe formée par des glycoprotéines.
Vient ensuite la cuticule, qui fournit une résistance à des températures élevées, suivie du cortex composé de peptidoglycane. Par la suite, il y a la base de la base qui protège le protoplaste.
La spore est une structure déshydratée qui contient 15% du calcium et de l'acide de dipycoline. Par conséquent, la plupart des techniques de coloration des spores sont basées sur l'application de chaleur afin que le colorant puisse pénétrer la structure épaisse.
Peut vous servir: lactogenèse: caractéristiques et étapesUne fois la spore tachée, elle ne peut pas éliminer le colorant. Dans la technique de Shaeffer-Fulton, le vert de la malachite entre dans les cellules végétatives et, en appliquant la chaleur, pénètre dans l'endospora.
Lors du lavage avec de l'eau, le colorant est retiré de la cellule végétative. Cela se produit parce que le colorant vert de la malachite est légèrement basique, donc la cellule végétative se lie faiblement.
Au lieu de cela, vous ne pouvez pas sortir de la spore et enfin le bacille avec safranine est embauché. Cette fondation est valable pour le reste des techniques, dans laquelle quelque chose de similaire se produit.
Techniques de coloration des spores
Pour effectuer la coloration des spores, vous devez avoir une récolte pure de la tension suspecte que vous souhaitez étudier.
La culture est soumise à des températures extrêmes pendant 24 heures pour stimuler le micro-organisme à la sporulaire. Pour cela, la récolte peut être placée dans un 44 ° C ou dans le réfrigérateur (8 ° C) pendant 24 ou 48 heures.
Si vous partez trop longtemps aux températures susmentionnées, seules les exospaures seront observés, car toutes les endospores auront quitté le Bacillus.
Temps culminé, quelques gouttes de solution physiologique stérile sur une diapositive propre doivent être placées. Puis une petite partie de la récolte est prise et une amende prolongée.
Par la suite, il est autorisé à sécher, il est fixé dans la chaleur et la teinture avec certaines des techniques expliquées ci-dessous:
Technique Dorner
- Préparez dans un tube à essai une suspension concentrée du micro-organisme sporulé dans de l'eau distillée et ajoutez un volume égal de fenicada fuchsina de kinyoun filtré.
- Placer le tube dans un bain avec de l'eau bouillante pendant entre 5 et 10 minutes.
- Sur une diapositive propre a mélangé une goutte de la suspension précédente avec une goutte de solution nigrosine aqueuse à 10%, bouillie et filtrée.
- S'étendre et sécher à feu doux.
- Examiner avec une cible 100x (immersion).
Les spores sont teintes rouges et les cellules bactériennes apparaissent presque incolores sur un fond gris foncé.
Peut vous servir: Helmintology: Origin, quelles études, exemple de rechercheTechnique Dorner modifiée
- Une suspension étendue du micro-organisme sporulé est fabriquée sur une diapositive et fixée à la chaleur.
- L'échantillon est recouvert d'une bande de papier filtre à laquelle Fenicada Fuchsin est ajoutée. Le colorant est chauffé de 5 à 7 minutes avec la flamme du briquet Bunsen jusqu'à ce que le détachement de vapeur soit généré. Ensuite, le papier est retiré.
- La préparation avec de l'eau est lavée puis sèche avec du papier absorbant.
- Le frottis est recouvert d'un film mince de 10% de nigrosine, en utilisant une deuxième diapositive pour étendre la nigrosine ou une aiguille.
La coloration prise par les spores et les bactéries est égale à celle décrite dans la technique précédente.
Technique Shaeffer-Fulton ou Wirtz-Conklin
- Faites une amende prolongée avec une suspension de micro-organisme sporulé sur une lame et réparez la chaleur.
- Couvrir la diapositive avec une solution aqueuse de malachite vert à 5% (un papier filtre peut être placé sur la feuille).
- Chauffer sur la flamme du briquet de Bunsen jusqu'à ce qu'il provoque le détachement de vapeur et retire la flamme. Répétez l'opération 6 à 10 minutes. Si pendant la procédure, la solution verte malachite s'évapore, plus peut être ajouté.
- Retirez le papier filtre (s'il est placé) et lavez à l'eau.
- Couvrir la diapositive avec 0,5% de safranine aqueuse pendant 30 secondes (certaines variantes de la technique utilisent une safranine aqueuse à 0,1% et laissez-la pendant 3 minutes).
Avec cette technique, les spores sont présentées vertes et les bacilles rouges.
Il a le désagrément que les endospores des jeunes cultures ne sont pas bien teintes, car elles ont l'air extrêmement claires ou incolores. Pour éviter cela, il est recommandé d'utiliser des cultures d'incubation à 48 heures.
Technique Möller
- Couvrir le frottis de chloroforme pendant 2 minutes.
- Jeter le chloroforme.
- Couvrir avec 5% d'acide chromique pendant 5 minutes.
- Laver à l'eau distillée.
- La feuille avec du carbol Fuchsin-Fenicada est couverte et exposée à la flamme du briquet Bunsen jusqu'à l'émission de vapeurs, puis il est retiré de la flamme quelques instants. L'opération est répétée jusqu'à 10 minutes.
- Laver à l'eau.
- Utilisez de l'éthanol acidifié (alcool chlorhydrique) pour décolorer. Il est laissé pendant 20 ou 30 secondes.
- Laver à l'eau distillée.
- Location couvrant la feuille de bleu de méthylène pendant 5 minutes.
- Laver à l'eau distillée.
- Il est autorisé à sécher et à emmener l'échantillon au microscope.
Les spores ont l'air rouge et les bacilles bleus. Il est important de ne pas aspirer aux vapeurs, car ils sont toxiques et à long terme, ils peuvent être cancérigènes.
Technique Möller modifiée sans chaleur
En 2007, Hayama et ses collaborateurs ont créé une modification de la technique de Möller. Ils ont éliminé la coloration du colorant et l'ont remplacée par l'ajout de 2 gouttes du tensioactif Tergitol 7 pour 10 ml de solution de carbol fasin-fine. Les mêmes résultats ont été obtenus.
Applications
La coloration des spores fournit des informations très précieuses et utiles pour l'identification du pathogène, car la présence de la même chose, sa forme, son emplacement dans le bacille et la capacité de déformer la cellule végétative ou non, sont des données qui peuvent guider les espèces sur les espèces impliquées dans un certain sexe.
Dans ce contexte, il convient de dire que les spores peuvent être rondes ou ovales, elles peuvent être situées au centre ou également en position palacentrale, subterminale ou terminale.
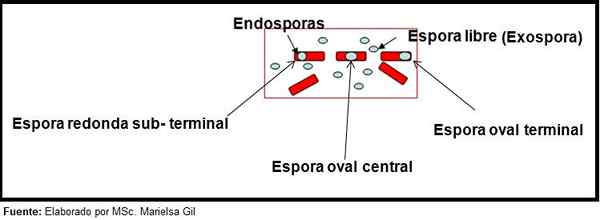 Schéma de la forme et de la position des endospores et de l'exospore
Schéma de la forme et de la position des endospores et de l'exospore Exemples
- Clostridium difficile Il forme une spore ovale dans une position terminale qui déforme le bacille.
- La spore de Clostridium Tertium Il est ovale, ne déforme pas le bacille et est situé au niveau terminal.
- L'endospora de Clostridium tétani Il est terminal et déforme le bacille, donnant l'apparence d'un bâton de tambour.
- Les spores de Clostridium botulinum, C. histolyticum, C. Novice et C. septicum Ils sont ronds ou ovales, sous terre et déforment le bacille.
- L'endospora de Clostridium Sordelli Il est situé dans la position centrale, avec une légère déformation.
Les références
- Teinture Moeller. Récupéré de.Wikipédia.org.
- Endospora. Récupéré de es.Wikipédia.org.
- Forbes, B., Sahm, D., Weissfeld, un. Diagnostic microbiologique de Bailey & Scott. Pan -American Editorial S.POUR.

