Histoire de la théorie cinétique moléculaire, postulates et exemples

- 2829
- 683
- Lucas Schneider
La Théorie cinétique moléculaire C'est celui qui cherche à expliquer les observations expérimentales des gaz dans une perspective microscopique. C'est-à-dire qu'il essaie d'associer la nature et le comportement des particules gazeuses, aux caractéristiques physiques du gaz comme fluide; Expliquer le macroscopique du microscopie.
Les gaz ont toujours été l'objet d'intérêt pour les scientifiques en raison de leurs propriétés. Ils occupent l'intégralité du volume du conteneur dans lequel ils sont, pouvant compresser complètement sans leur contenu s'opposant à la résistance plus faible; Et si la température augmente, le récipient commence à se développer et peut même se fissurer.
 Particules gazeuses dans des conditions lointaines ou près de la liquéfaction. Source: Olivier Cleynen et utilisateur: Sharayanan [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Particules gazeuses dans des conditions lointaines ou près de la liquéfaction. Source: Olivier Cleynen et utilisateur: Sharayanan [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Beaucoup de ces propriétés et comportements sont résumés dans les lois des gaz idéaux. Cependant, ils considèrent le gaz dans son ensemble et non comme un ensemble de millions de particules dispersées dans l'espace; De plus, il ne fournit pas, à partir des données de pression, de volume et de température, plus d'informations sur la façon dont ces particules se déplacent.
C'est ainsi que la théorie cinétique moléculaire (TCM), propose de les visualiser sous forme de sphères mobiles (image supérieure). Ces sphères entrent en collision les unes avec les autres et les murs arbitrairement, et maintiennent une trajectoire linéaire. Cependant, lorsque la température diminue et que la pression augmente, la trajectoire des sphères devient courbe.
Un gaz, selon le TCM, doit se comporter comme les sphères de la première boîte d'image. Mais, lorsqu'il est refroidi et augmente la pression sur eux, leur comportement s'éloigne de l'idéal. Ce sont alors des gaz réels, près de la liquéfaction et vont à la phase liquide.
Dans ces conditions, les interactions entre les sphères deviennent plus importantes, au point que leurs vitesses. Plus ils sont proches de la liquéfaction, plus leurs trajectoires sont courbes (boîte à droite) et leurs collisions sont moins d'énergie.
[TOC]
Histoire
Daniel Bernoulli
L'idée de ces sphères, mieux appelée atomes, avait déjà été considérée par le philosophe romain Lucretius; Pas pour les gaz, mais pour les objets solides et statiques. D'un autre côté, en 1738, Daniel Bernoulli a appliqué la vision atomique aux gaz et aux liquides en les imaginant comme des sphères désordonnées se déplaçant dans toutes les directions.
Son travail, cependant, a violé les lois de la physique à l'époque; Un corps ne pouvait pas bouger éternellement, il était donc impossible de penser qu'un ensemble d'atomes et de molécules est entré en collision les uns avec les autres sans perte de leur énergie; c'est-à-dire que l'existence de collisions élastiques n'était pas possible.
Rudolf Clausius
Un siècle plus tard, d'autres auteurs ont renforcé le TCM avec un modèle où les particules gazeuses se sont déplacées dans une direction. Rudolf Clausius, cependant, a compilé ses résultats et armé un modèle plus complet du TCM avec lequel il a cherché à expliquer les lois sur le gaz idéales démontrées par Boyle, Charles, Dalton et Avogadro.
Peut vous servir: Coulombimétrie: fondamentaux, types, applicationsJames Clerk Maxwell et Ludwig Boltzmann
En 1859, le greffier de James Maxwell a déclaré que les particules gazeuses présentent une gamme de vitesses à une température donnée, et qu'un ensemble peut être considéré au moyen d'une vitesse moléculaire moyenne.
Puis, en 1871, Ludwig Boltzmann a connecté les idées existantes avec l'entropie, et comment thermodynamiquement a toujours tendance à occuper l'espace maximal possible d'une manière homogène et spontanée.
Postuler la théorie cinétique moléculaire
Pour considérer le gaz de ses particules, un modèle dans lequel certains postulats ou hypothèses sont respectés; postulé que logiquement devrait être en mesure de prédire et d'expliquer (aussi fidèle que possible) les observations macroscopiques et expérimentales. Cela dit, les postulats du TCM sont mentionnés et décrits.
Le volume de particules gazeux est négligeable
Dans un récipient plein de particules gazeuses, ils se dispersent et s'éloignent entre eux dans tous les coins. Si pendant un moment, ils pouvaient tous se rencontrer à un moment spécifique du conteneur, sans liquéfaction, il serait observé qu'ils occupent à peine une partie méprisable du volume du conteneur.
Cela signifie que dans le conteneur, même s'il contient des millions de particules gazeuses, il est vraiment plus vide que le plein (rapport volume-Vacío beaucoup moins de 1); Par conséquent, si ses barrières le permettent, lui et le gaz à l'intérieur peuvent être comprimés brusquement; car en compte, les particules sont très petites, tout comme leur volume.
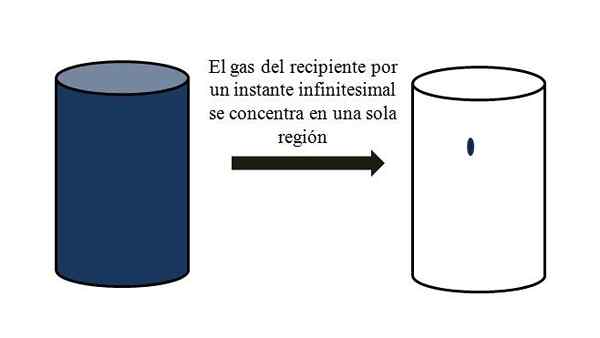 Relation du volume-vacío d'un gaz dans un conteneur. Source: Gabriel Bolívar.
Relation du volume-vacío d'un gaz dans un conteneur. Source: Gabriel Bolívar. L'image supérieure illustre précisément ce qui est commenté ci-dessus, en utilisant un gaz bleuâtre.
Les forces d'attraction entre les particules sont nuls
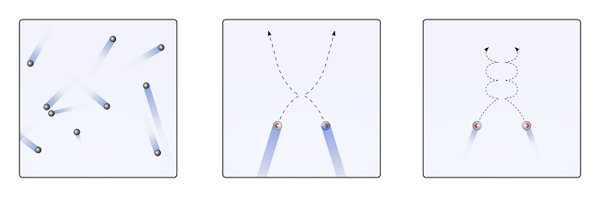
Les particules gazeuses à l'intérieur du récipient entrent en collision entre elles sans suffisamment de temps pour que leurs interactions deviennent de la force; Encore moins alors que ce qui les entoure principalement est moléculaire vide. Une conséquence immédiate de cela est que leurs trajectoires linéaires leur permettent de couvrir complètement le volume du conteneur.
Si ce qui précède n'était pas le cas, un conteneur "bizarre" et "labyrinthique" aurait des régions humides à la suite de la condensation du gaz; Au lieu de cela, les particules parcourent tout le récipient en pleine liberté, sans la force de leurs interactions les arrêtant.
Peut vous servir: acide chlorique (HCLO3) Dépos des particules gazeuses lorsque les interactions sont nulles ou insignifiantes (à., linéaire), et quand ils sont importants (b., courbes). Source: Gabriel Bolívar.
Dépos des particules gazeuses lorsque les interactions sont nulles ou insignifiantes (à., linéaire), et quand ils sont importants (b., courbes). Source: Gabriel Bolívar. Les trajectoires linéaires de l'image supérieure (un.) démontrer ce postulat; Tandis que si les trajectoires sont des courbes (b.), preuve qu'il existe des interactions qui ne peuvent pas être ignorées parmi les particules.
Les particules gazeuses sont toujours en mouvement
Des deux premiers postulats convergent en plus le fait que les particules de gaz ne cessent de bouger. Une fois floues dans le récipient, ils entrent en collision les uns avec les autres et avec les murs de la même chose, avec une force et une vitesse directement proportionnelles à la température absolue; Cette force est, la pression.
Si les particules gazeuses cessent de se déplacer dans un instant, elle serait observée à l'intérieur des «langues de fumée», résultant de rien, avec suffisamment de temps pour se commander dans le vide et donner des façons aléatoires.
Les collisions entre les particules et les parois du récipient sont élastiques
Si les collisions élastiques entre les particules gazeuses et les parois du récipient ne se produiront jamais dans le récipient, elle ne se produira jamais (tandis que les conditions physiques ne changent pas) la condensation du gaz; Ou qu'est-ce qui est la même chose que de dire qu'ils ne se reposent jamais et qu'ils entrent toujours en collision.
En effet, dans les collisions élastiques, il n'y a pas de perte nette d'énergie cinétique; Une particule entre en collision avec le mur et rebondit à la même vitesse. Si une particule lorsque la collision diminue la vitesse, l'autre accélère, sans chaleur ni son qui dissipe l'énergie cinétique de l'un d'eux.
L'énergie cinétique ne reste pas constante
Le mouvement des particules est aléatoire et chaotique, de sorte que tous ne portent pas la même vitesse; comme cela se produit, par exemple, sur une autoroute ou dans une foule. Certains sont plus énergiques et voyagent plus de vitesse, tandis que d'autres sont lents, attendant qu'une collision les accélère.
Pour décrire votre vitesse, il est alors nécessaire de calculer une moyenne; Et avec cela, l'énergie cinétique moyenne des particules ou des molécules de gaz est obtenue. Comme l'énergie cinétique de toutes les particules change constamment, la moyenne permet un meilleur contrôle des données et vous pouvez travailler avec une plus grande fiabilité.
L'énergie cinétique moyenne est égale à une température donnée pour tous les gaz
Énergie cinétique moléculaire moyenne (CEDéputé) Dans un conteneur, il est modifié avec la température. À une température plus élevée, cette énergie sera plus élevée. Parce que c'est une moyenne, il peut y avoir des particules ou des sodas qui ont une énergie plus ou moins importante par rapport à cette valeur; Certains plus rapides et plus lents, respectivement.
Peut vous servir: acides et bases: différences, caractéristiques, exemplesMathématiquement, il peut être démontré que la CEDéputé Cela dépend exclusivement de la température. Cela signifie que peu importe ce que le gaz, sa masse ou sa structure moléculaire, sa CEDéputé Il sera la même à une température t et ne variera que s'il augmente ou diminue. De tous les postulats, c'est peut-être le plus pertinent.
Et qu'en est-il de la vitesse moléculaire moyenne? Contrairement à ECDéputé, La masse moléculaire influence la vitesse. Plus la particule ou la molécule de gaz est lourde, il est naturel de s'attendre à se déplacer plus lentement.
Exemples
Voici quelques brefs exemples de la façon dont TCM a réussi à donner des explications aux lois des gaz idéaux. Bien qu'ils ne soient pas traités, d'autres phénomènes, tels que la diffusion et l'épanchement des gaz, peuvent également être expliqués avec le TCM.
Boyle Law
Si le volume du récipient est comprimé à température constante, la distance que les particules gazeuses doivent entrer en collision pour colliter contre les parois diminuent; qui est égal à une augmentation de la fréquence de ces collisions, entraînant une plus grande pression. Lorsque la température est constante, ECDéputé C'est aussi constant.
Law Charles
Si t, EC augmenteDéputé augmentera. Les particules gazeuses se déplaceront plus rapidement et entrent en collision un plus grand nombre de fois avec les parois du conteneur; augmente la pression.
Si les murs sont flexibles, capables de se développer, sa zone deviendra plus grande et la pression baissera jusqu'à ce qu'elle devienne constante; Et par conséquent, le volume augmentera également.
La loi de Dalton
Si plusieurs litres de gaz différents étaient ajoutés dans un récipient spacieux, à partir de conteneurs plus petits, leur pression interne totale serait égale à la somme des pressions partielles exercées par chaque type de gaz séparément.
Parce que? Parce que tous les gaz commencent à entrer en collision les uns avec les autres et à se disperser de manière homogène; Les interactions entre elles sont vides, et l'aspirateur prédomine dans le récipient (postule du TCM), c'est donc comme si chaque gaz était seul, exerçant sa pression de manière individuelle sans l'interférence des autres gaz.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning, p 426-431.
- Fernández Pablo. (2019). Théorie cinétique moléculaire. Vix. Récupéré de: vix.com
- Jones, Andrew Zimmerman. (7 février 2019). Théorie moléculaire cinétique des gaz. Récupéré de: Thoughtco.com
- Hall Nancy. (5 mai 2015). Théorie cinétique des gaz. Glenn Research Center. Récupéré de: grc.pot.Gouvernement
- Blaber m. & Inférieur s. (9 octobre 2018). Bases de la théorie moléculaire cinétique. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- La théorie moléculaire cinétique. Récupéré de: Chemed.Chem.Purger.Édu
- Wikipédia. (2019). Théorie cinétique des gaz. Récupéré de: dans.Wikipédia.org
- Toppr. (s.F.). Théorie moléculaire cinétique des gaz. Récupéré de: toppr.com

