Tableau des éléments périodiques
- 1357
- 262
- Louna Baron
Quel est le tableau périodique des éléments?
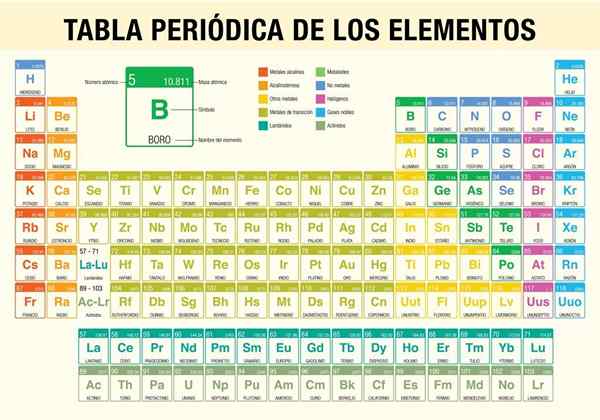
La Tableau des éléments périodiques C'est un outil qui vous permet de consulter les propriétés chimiques des 118 éléments connus jusqu'à présent. Il est indispensable lors de la réalisation de calculs stoechiométriques, de la prévision des propriétés physiques d'un élément, de les classifier et de trouver des propriétés périodiques parmi toutes.
Les atomes deviennent plus lourds car leurs noyaux ajoutent des protons et des neutrons, qui doivent également être accompagnés de nouveaux électrons; Sinon, l'électroneutralité ne serait pas possible. Ainsi, certains atomes sont très légers, comme l'hydrogène, et d'autres, des superpesados, comme Oganerson.
C'est le scientifique Dmitri Mendeléyev, qui en 1869 (il y a près de 150 ans) a publié, après une décennie d'études théoriques et d'expériences, le premier tableau périodique pour tenter d'organiser les 62 éléments connus à l'époque à l'époque.
Quel est le tableau périodique pour?
Les principales utilisations de la table sont:
- Connaître le symbole et le nom de chaque élément chimique qui existe.
- Connaître la masse atomique et le nombre atomique de l'élément.
- Informer des relations entre les différents éléments.
- Montrez les différentes tendances (périodicité).
- Classification des types d'éléments chimiques. Ces types comprennent les métaux alcalins, les métaux de base, les métaux de transition, les non-métaux, les gaz nobles, les halogènes, les terres alcalines, les demi-métaux, les actinides et les lanthanidés.
- Prédire les propriétés de nouveaux éléments non encore découverts ou non synthétisés.
Comment le tableau périodique est-il organisé? (Structure et organisation)
Périodes
Les éléments sont commandés en lignes ou périodes en fonction du niveau d'énergie de ses orbitales. Avant la période 4, lorsque les éléments ont suivi dans l'ordre croissant de la masse atomique, c'est que pour huit d'entre eux, les propriétés chimiques se sont répétées (loi des octaves, par John Newlands).
Les métaux de transition se sont faufilés dans d'autres éléments non métalliques, tels que le soufre et le phosphore. Pour cette raison, l'entrée de la physique quantique et des configurations électroniques pour la compréhension des tables périodiques modernes était vitale.
Les orbitales d'une couche d'énergie sont remplies d'électrons (et les noyaux des protons et des neutrons), alors qu'il se déplace sur une période. Cette couche d'énergie va de pair avec la taille ou la radio atomique; Par conséquent, les éléments des périodes supérieures sont plus petites que celles trouvées ci-dessous.
Le H et le I ont trouvé dans le premier niveau d'énergie (période); la première rangée de boîtes grises, en quatrième période; et la rangée des boîtes Ananjadas, dans la sixième période. Notez que, bien que ce dernier semble être dans la neuvième période présumée, il appartient en fait au sixième, juste après la boîte jaune de BA.
Groupes
En tournée d'une période, c'est que la masse, le nombre de protons et d'électrons augmentent. Dans la même colonne ou le même groupe, bien que la masse et les protons varient, le nombre de Electrons de couche de valence C'est lui-même.
Par exemple, dans la première colonne ou groupe, le H n'a qu'un seul électron dans l'orbital 11, Comme le li (2s1), Le sodium (3s1), Potassium (4S1) Et ainsi de suite au Francio (7s1). Ce numéro 1 indique que ces éléments ont à peine un électron Valencia et appartiennent donc au groupe 1 (AI). Chaque élément est dans différentes périodes.
Sans compter l'hydrogène, la boîte verte, les éléments sous celui-ci proviennent de boîtes orange et sont appelés métaux alcalins. Un autre dans la boîte de droite de toute période est le groupe ou la colonne 2; c'est-à-dire que ses éléments ont deux électrons de valence.
Peut vous servir: performance théoriqueMais lorsque vous vous déplacez vers la droite, à l'insu des orbitales D, vous atteignez le groupe Boro (B) ou le groupe 13 (IIIA); Au lieu du groupe 3 (iiib) ou du scandio (sc). En tenant compte du remplissage des orbitales D, les périodes des boîtes grises commencent à être voyagées: les métaux de transition.
Nombres de protons vs électrons de Valence
Lors de l'étude du tableau périodique, une confusion peut se produire entre le nombre atomique Z ou le nombre de protons totaux dans le noyau et la quantité d'électrons de valence. Par exemple, le carbone a un z = 6, c'est-à-dire qu'il a six protons et donc six électrons (sinon il ne pourrait pas être un atome avec une charge neutre).
Mais, de ces six électrons, Quatre viennent de Valence. Pour cette raison, sa configuration électronique est [il] 2s22 P2. [Il] désigne les deux électrons 12 de la couche fermée, et théoriquement ne participent pas à la formation de liens chimiques.
De plus, parce que le carbone a quatre électrons de valence, "commodément" est situé dans le groupe 14 (TVA) du tableau périodique.
Les éléments en dessous du carbone (oui, GE, SN, PB et FL) ont des nombres atomiques (et atomiques) plus élevés; Mais tout le monde a en commun les quatre électrons de Valence. C'est la clé de la compréhension de la raison pour laquelle un élément appartient à un groupe et non à un autre.
Éléments du tableau périodique
Blocs S
Comme expliqué, les groupes 1 et 2 sont caractérisés par un ou deux électrons dans les orbitales s. Ces orbitales sont une géométrie sphérique, et comme l'un de ces groupes descend, les éléments acquièrent des couches qui augmentent la taille de leurs atomes.
Pour présenter des tendances fortes dans leurs propriétés chimiques et leurs modes de réaction, ces éléments sont organisés comme des blocs S. Par conséquent, les métaux alcalins et les métaux d'alcalinerie appartiennent à ce bloc. La configuration électronique des éléments de ce bloc est NS (1S, 2S, etc.).
Bien que l'élément d'hélium soit à l'extrémité supérieure droite du tableau, sa configuration électronique est 12 Et appartient donc à ce bloc.
Bloc P
Contrairement aux blocs S, les éléments de ce bloc présentent des orbitales complètement complètes, tandis que leurs orbitales P continuent de se remplir d'électrons. Les configurations électroniques des éléments appartenant à ce bloc sont du type ns2NP1-6 (P Les orbitales peuvent avoir un ou jusqu'à six électrons à remplir).
Donc, dans quelle partie du tableau périodique est ce bloc? À droite: les boîtes vertes, habitantes et bleues; C'est-à-dire des éléments non métalliques et des métaux lourds, comme le bismuth (BI) et le plomb (PB).
En commençant par le boron, avec une configuration électronique NS2NP1, Le carbone à votre droite ajoute un autre électron: 2s22 P2. Ensuite, les configurations électroniques des autres éléments de la période 2 du bloc P sont: 2S22 P3 (azote), 2s22 P4 (oxygène), 2s22 P5 (fluorure) et 2s22 P6 (néon).
Si les périodes inférieures sont abaissées, le niveau d'énergie 3: 3 aura23p1-6, Et ainsi de suite jusqu'à la fin du bloc P.
Notez que la chose la plus importante dans ce bloc est que, à partir de la période 4, ses éléments ont complètement rempli des orbitales (les boîtes bleues vers la droite). En résumé: le bloc S est à gauche du tableau périodique et le bloc P, à droite.
Éléments représentatifs
Quels sont les éléments représentatifs? Ce sont ceux qui, d'une part, perdent facilement les électrons, ou de l'autre, ils les gagnent pour compléter l'octet de Valence. En d'autres termes: ce sont les éléments des blocs S et P.
Peut vous servir: émulsifiant: processus d'émulsion, aspects moléculaires, applicationsLeurs groupes se sont distingués des autres au moyen d'une lettre A à la fin. Ainsi, il y avait huit groupes: de l'IA à VIIIA. Mais actuellement, le système de numérotation utilisé dans les tables périodiques modernes est l'arabe, de 1 à 18 ans, y compris les métaux de transition.
Pour cette raison, le groupe Boro peut être l'IIIA, ou 13 (3 + 10); le groupe de carbone, la TVA ou 14; et celui des gaz nobles, le dernier à droite de la table, viiia ou 18.
Métaux de transition
Les métaux de transition sont tous les éléments des boîtes grises. Tout au long de leurs règles, leurs orbitales sont remplies, qui sont de cinq ans et peuvent donc avoir dix électrons. Comme dix électrons devraient avoir à remplir les orbitales, alors il doit y avoir dix groupes ou colonnes.
Chacun de ces groupes dans l'ancien système de numérotation a été désigné avec des numéros romains et une lettre B à la fin. Le premier groupe, celui du Scandio, était l'IIIB (3), le fer, le cobalt et le nickel viiib pour avoir des réactivités très similaires (8, 9 et 10), et celle du zinc IIB (12).
Comme on peut le voir, il est beaucoup plus facile de reconnaître les groupes par des nombres arabes que d'utiliser des nombres romains.
Métaux de transition interne
À partir de la période 6 du tableau périodique, les orbitales F commencent à être disponibles énergiquement. Ceux-ci doivent être remplis d'abord que les orbitales d; Et par conséquent, ses éléments sont généralement placés séparés afin de ne pas trop étendre la table.
Les deux dernières périodes, orange et grisâtre. Il y a sept orbitales F, qui ont besoin de quatorze électrons à remplir, et donc, il doit y avoir quatorze groupes.
Si ces groupes sont ajoutés au tableau périodique, il y en aura 32 au total (18 + 14) et aura une version «allongée»:
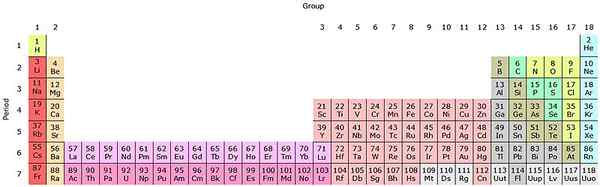 Source: par Sandbh [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons
Source: par Sandbh [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons La rangée rose claire correspond aux lantanoides, tandis que la rangée rose foncé les actinoïdes. Le lantano, le avec z = 57, l'Actinio, AC avec z = 89, et le bloc entier F appartient au même groupe du Scandio. Parce que? Parce que le scandio a une nd orbitale1, qui est présent dans le reste des lantanoides et des actinoïdes.
Les et ac ont des paramètres de valence 5D16s2 et 6d17s2. Lorsque vous vous déplacez à droite sur les deux lignes, les orbitales 4F et 5F commencent à remplir. Une fois plein, vous atteignez les éléments Luthacio, Lu et Laurencio, LR.
Métaux et non-métaux
Laissant le gâteau de la table périodique derrière, il est plus pratique de recourir à celui de l'image supérieure, même sous sa forme allongée. À l'heure actuelle, la grande majorité des éléments susmentionnés ont été des métaux.
À température ambiante, tous les métaux sont des substances solides (sauf le mercure, qui est liquide) de gris argenté (sauf pour le cuivre et l'or). Ils sont également généralement durs et brillants; Bien que ceux des blocs soient doux et fragiles. Ces éléments sont caractérisés par leur facilité de perdre des électrons et de former des cations m+.
Dans le cas des lantanoïdes, les trois électrons perdent 5d16s2 Pour devenir des cations trivales m3+ (comme elle3+). La colline, quant à elle, est en mesure de perdre quatre électrons (CE4+).
D'un autre côté, les éléments non métalliques constituent la partie la moins importante du tableau périodique. Ce sont des gaz ou des solides avec des atomes liés de manière covalente (comme le soufre et le phosphore). Tous sont situés dans le bloc P; Plus précisément, dans la partie supérieure de celui-ci, car les descendant vers les périodes inférieures augmentent le caractère métallique (BI, PB, PO).
De plus, les non-métaux au lieu de perdre des électrons, les gagnent. Ainsi, ils forment des anions x- Avec différentes charges négatives: -1 pour les halogènes (groupe 17) et -2 pour les calcogens (groupe 16, oxygène).
Peut vous servir: alcool éthylique: structure, propriétés, utilisations, obtentionFamilles de métaux
Dans les métaux, il existe une classification interne pour les différencier de:
- Les métaux du groupe 1 sont alcalins.
- Groupe 2, Métaux alcalinerrior (SR. Scholambara).
- Groupe 3 (IIB) Famille Scandio. Cette famille est composée du Scandio, du groupe de groupe, de l'Ititrum et, du Lantano, d'Actio et de tous les Lantanoides et Actinoides.
- Groupe 4 (IVB), Famille Titanium: Ti, Zr (Cirmonium), HF (Hafnio) et RF (Rutherfordio). Combien d'électrons de Valence ont? La réponse est dans votre groupe.
- Groupe 5 (VB), famille Vanadio. Groupe 6 (VIB), Chrome Family. Et ainsi de suite à la famille du zinc, groupe 12 (IIB).
Métalloïdes
Le caractère métallique augmente de droite à gauche et de haut en bas. Mais quelle est la frontière entre ces deux types d'éléments chimiques? Cette frontière est composée d'éléments appelés métalloïdes, qui ont des caractéristiques des métaux et des non-métaux.
Les métalloïdes peuvent être vus dans le tableau périodique de «l'escalier» qui commence par du bore et se termine par l'élément radioactif Astato. Ces éléments sont:
- B: Boro.
- Silicon: Oui.
- GE: Germanio.
- AS: Arsenic.
- SB: Antimoine.
- TE: Télurio.
- AT: Astato.
Chacun de ces sept éléments présente des propriétés intermédiaires, qui varient selon l'environnement chimique ou la température. L'une de ces propriétés est le semi-conduite, c'est-à-dire que les métalloïdes sont des semi-conducteurs.
Des gaz
Dans des conditions terrestres, les éléments gazeux sont ces métaux non légers, tels que l'azote, l'oxygène et le fluor. De plus, le chlore, l'hydrogène et les gaz nobles entrent dans cette classification. De tous, les plus emblématiques sont les gaz nobles, pour leur faible tendance à réagir et à se comporter comme des atomes libres.
Ce dernier se trouve dans le groupe 18 du tableau périodique et sont:
- Helio, il.
- Néon, ne.
- Argon, ar.
- Kripton, KR.
- Xenón, Xe.
- Radón, RN.
- Et le plus récent de tous, le noble gaz de l'oganèse synthétique, OG.
Tous les gaz nobles ont en commun la configuration de Valencia ns2NP6; c'est-à-dire qu'ils ont terminé l'octet de Valence.
L'agrégation se dresse à d'autres températures
Les éléments sont en état solide, liquide ou gazeux en fonction de la température et de la résistance de leurs interactions. Si la température de la Terre se refroidit jusqu'à ce que le zéro absolu (0k) soit autour, alors tous les éléments se congeleraient; sauf pour l'hélium, qui se condenserait.
À cette température extrême, le reste des gaz serait sous forme de glace.
À l'autre extrême, si la température était d'environ 6000K, "tous" les éléments seraient dans un état gazeux. Dans ces conditions, des nuages d'or, d'argent, de plomb et d'autres métaux pouvaient littéralement observer.
Importance du tableau périodique
Actuellement, le tableau périodique est l'instrument organisationnel le plus important de la chimie en raison des relations détaillées de ses éléments. Son utilisation est essentielle pour les étudiants et les enseignants et pour les chercheurs et de nombreux professionnels dédiés à la branche de la chimie et de l'ingénierie.
En regardant simplement le tableau périodique, une immense quantité et des informations sont obtenues rapidement et efficacement, telles que:
- Lithium (li), béryllium (be) et bore (b) conduire de l'électricité.
- Le lithium est un métal alcalin, le béryllium est un métal alcalin et un bore n'est pas un métal.
- Le lithium est le meilleur conducteur des trois nommés, suivi du béryllium et, enfin, du boron (semi-conducteur).
Ainsi, en localisant ces éléments dans le tableau périodique, sa tendance à la conductivité électrique peut être instantanément conclue.