Structure de sulfate de manganèse (MNSO4), propriétés, obtention, utilisations

- 3242
- 261
- Paul Dumas
Il sulfate de manganèse (II) C'est un solide inorganique formé par les éléments de manganèse (MN), le soufre (s) et l'oxygène (O). Sa formule chimique est MSO4. Sa forme anhydre (sans eau dans sa structure) est un solide blanc. Cependant, il a plusieurs formes hydratées et toutes sont des solides roses.
Le sulfate de manganèse en très petites (minuscules) quantités est utilisé comme micronutriment pour les animaux et les humains, car il est nécessaire pour le fonctionnement normal de l'organisme.
 Sulfate de manganèse anhidro mNSO4. YOSF0113 à l'anglais wikipedia / domaine public. Source: Wikimedia Commons.
Sulfate de manganèse anhidro mNSO4. YOSF0113 à l'anglais wikipedia / domaine public. Source: Wikimedia Commons. Il est également ajouté avec certains engrais dans des sols déficientes dans le manganèse (MN) pour les cultures agricoles qui en ont besoin, comme les plantes de raisin.
En raison de la coloration rose de ses variétés hydratées, il est utilisé dans les pigments qui servent à peindre la céramique, les tissus coloriants et autres matériaux. Il sert également à obtenir d'autres composés de manganèse.
Les mons4 doit être manipulé avec soin. Son inhalation peut causer des problèmes respiratoires et produire de graves inconvénients dans le système nerveux, qui comprennent des symptômes similaires à la maladie de Parkinson.
Son excès peut également endommager la terre et les animaux et les plantes aquatiques.
[TOC]
Structure
Le sulfate de manganèse anhydre (sans eau dans sa structure cristalline) est formé par un ion manganèse dans l'oxydation +2, c'est-à-dire Mn2+ et un anion sulfate donc42-.
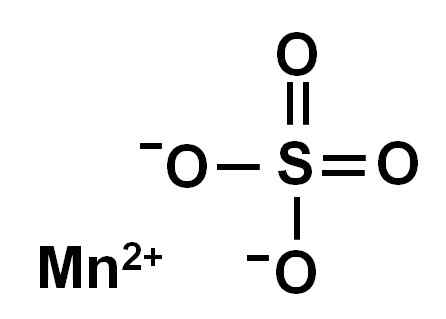 Structure chimique du sulfate de manganèse4. Auteur: Marilú Stea.
Structure chimique du sulfate de manganèse4. Auteur: Marilú Stea. Nomenclature
- Sulfate de manganèse (II)
- Monosulfate de manganèse
- Sulfate de manganèse anhidro mNSO4
- Manganèse sulfate de manganèse MSSO4 •H2SOIT
- Tétrahydrate de sulfate de manganèse4 •4h2SOIT
- Sulfate de manganèse pentahydrate4 •5h2SOIT
- Hepthydrated manganèse sulfate4 •7h2SOIT
Propriétés
État physique
Les mons4 Anhydre (sans eau dans sa structure) est un solide blanc cristallin. Cependant, les variétés hydratées sont des solides roses ou rouges pâles.
 Manganeso sulfate tétrahydrate mNSO4.4h2Ou est un solide rose. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons.
Manganeso sulfate tétrahydrate mNSO4.4h2Ou est un solide rose. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons. Poids moléculaire
MSSO4 = 151 g / mol
MSSO4 •H2O = 169,02 g / mol
Point de fusion
MSSO anhydre4 = 700 ºC
MSSO monohydraté4 •H2O = 400-450 ° C
Tétrahydrate massive4 •4h2O = 30 ° C
Point d'ébullition
MSSO anhydre4 = Il se décompose à 850 ºC.
Il peut vous servir: chlorure de cobalt (Cocl2 (: structure, nomenclature, propriétésTétrahydrate massive4 •4h2O = 850 ° C
Densité
MSSO4 = 3,25 g / cm3
MSSO4 •H2O = 2,95 g / cm3
Solubilité
Très soluble dans l'eau: 52 g / 100 ml d'eau à 5 ° C. Alcool soluble. Insoluble dans l'éther. Légèrement soluble dans le méthanol.
pH
Une solution monse4 •H2Ou 5% a un pH de 3,7.
Propriétés chimiques
Lors de la dissolution dans l'eau, le MNSO4 est séparé en ses ions Mn2+ Et ainsi42-.
L'ion manganèse (ii) Mn2+ En solution acide ou neutre, il est lié à 6 molécules d'eau2Ou formant l'ion hexaacuomanganais [Mn (h2SOIT)6]]2+, qui est rose.
L'ion hexaacuomanganais [Mn (h2SOIT)6]]2+ Il est assez résistant à l'oxydation. En milieu de base (pH alcalin), cet ion devient un hydroxyde de manganèse (II) Mn (OH)2, qui est facilement oxydé, formant des composés de manganèse (III) et du manganèse (IV).
 Solutions MSSO4 Les acides sont roses par la présence de l'ion hexaacuomanganais [Mn (H2SOIT)6]]2+. Auteur: Steve Cross. Source: Pixabay.Le sulfate de manganèse a plusieurs formes hydratées, c'est-à-dire avec l'eau h2Ou dans sa structure cristalline.
Solutions MSSO4 Les acides sont roses par la présence de l'ion hexaacuomanganais [Mn (H2SOIT)6]]2+. Auteur: Steve Cross. Source: Pixabay.Le sulfate de manganèse a plusieurs formes hydratées, c'est-à-dire avec l'eau h2Ou dans sa structure cristalline.
Ce sont des mso monohydratés4 •H2Ou, Tetrahydrate MSO4 •4h2Ou, mnse pentahydrate4 •5h2O et hepthydrate mso4 •7h2SOIT. Ces formes hydratées contiennent l'ion hexaacuomanganais [Mn (h2SOIT)6]]2+ Dans leurs cristaux et pour cette raison, ce sont des solides roses.
Le monohydrate menso4 •H2Ou il est légèrement efflorescent, ce qui signifie qu'il perd lentement une partie de son eau d'hydratation lorsqu'il est exposé à l'environnement.
Obtention
Les mons4 Peut être obtenu en traitant l'oxyde de manganèse (II) MNO, MN Manghanous Hydroxyde (OH)2 O carbonate de manganèse (II) MNCO3 Avec de l'acide sulfurique H2Swin4.
MNCO3 + H2Swin4 → MSSO4 + H2Ou + CO2
Applications
Comme complément nutritionnel
Le sulfate de manganèse en petites quantités sert certaines fonctions du corps humain et des animaux.
C'est pourquoi il est important comme composé utile en nutrition et est fourni comme complément alimentaire. Il est utilisé en traces (quantités extrêmement petites).
Des quantités élevées peuvent être très toxiques et nocives.
En médecine vétérinaire
Les mons4 Les oiseaux de corral (poulets, dindes, canards et phaisanes) sont administrés pour empêcher la carence ou le manque d'élément de manganèse chez ces animaux.
Peut vous servir: iodate de potassium (kio3)Le manque de manganèse s'y manifeste, par exemple, comme la maladie appelée perose, qui est la déformation des os des jeunes jambes d'oiseaux.
 Les patitos peuvent nécessiter des traces de Monste4 Dans son alimentation pour prévenir la perulose. Auteurs: s. Hermann & F. Richter. Source: Pixabay.
Les patitos peuvent nécessiter des traces de Monste4 Dans son alimentation pour prévenir la perulose. Auteurs: s. Hermann & F. Richter. Source: Pixabay. Il s'applique à l'alimentation de ces oiseaux en très petites quantités ou traces.
En agriculture
Le sulfate de manganèse est utilisé comme micronutriment dans les engrais pour les vignes (plantes de raisin) et les plantations de tabac dans des échelles déficientes dans le manganèse.
Cependant, certaines études indiquent qu'un excès de sulfate de manganèse peut inhiber ou réduire la formation de certaines enzymes importantes pour la croissance des plantes et leurs épidémies.
 Dans certains cas, il applique mNSO4 au sol où sont les plantes de raisin. Auteur: Schwoaze. Source: Pixabay.
Dans certains cas, il applique mNSO4 au sol où sont les plantes de raisin. Auteur: Schwoaze. Source: Pixabay. Par exemple, il a été constaté qu'il est toxique pour certaines cultures comme le coton.
Les mons4 Il a également utilisé dans les fongicides et avec certains composés organiques fait partie de certains pesticides.
Dans plusieurs applications
Les mons4 Hydrated est utilisé par sa coloration pour préparer des pigments inorganiques utilisés dans des vernis rouges pour la céramique, dans les tissus et autres colorants de matériaux.
Le sulfate de manganèse est utilisé dans la fabrication de verre et les savons sont également préparés avec.
 Certaines carreaux de céramique peuvent contenir des pigments de sulfate de manganèse. Auteur: Dwilliams. Source: Pixabay.
Certaines carreaux de céramique peuvent contenir des pigments de sulfate de manganèse. Auteur: Dwilliams. Source: Pixabay. Les mons4 C'est le matériau de départ pour obtenir le métal manganèse (MN) électrolytique, c'est-à-dire en appliquant l'électricité aux solutions aqueuses.
Il vous permet également d'obtenir du dioxyde de manganèse2 et carbonate de manganèse3.
Les mons4 Il est également utilisé pour l'analyse chimique et dans la formulation de solutions utilisées dans des expériences de génétique avec des micro-organismes.
Des risques
Le sulfate de manganèse contient l'ion manganèse (II) (Mn2+), qui peut être à la fois inoffensif et toxique en fonction des quantités auxquelles la personne, l'animal ou la plante est exposée.
Le manganèse est essentiel pour le fonctionnement normal de l'organisme des humains, des animaux et certaines plantes. Mais malheureusement, le manganèse est également neurotoxique, c'est-à-dire qu'il affecte le système nerveux et certaines fonctions végétales.
Peut vous servir: qui a conçu le premier thermomètre moderne?Des quantités apparemment sûres
Les mons4 administré avec des aliments en forme de nourriture (quantités extrêmement petites ou minuscules) est généralement sûre par l'administration des aliments et des médicaments, ou FDA (acronyme pour l'anglais Food and Drug Administration).
Quantités dangereuses
Une exposition prolongée ou répétée à ce composé en quantités appréciables peut nuire à l'être humain et aux animaux.
Il produit une irritation dans les yeux muqueux et les muqueuses des voies respiratoires, l'anorexie, les maux de tête, la perte d'équilibre, la pneumonie et les infections respiratoires.
L'inhalation chronique cause des dommages au système nerveux, générant le manghanisme, tremblement dans les mains et symptômes typiques de la maladie de Parkinson.
 Le sulfate de manganèse affecte le système nerveux. Auteur: Sabine Zierer. Source: Pixabay.
Le sulfate de manganèse affecte le système nerveux. Auteur: Sabine Zierer. Source: Pixabay. Par conséquent, la dispersion de la poussière de MSO doit être évitée4, Utiliser des équipements respiratoires et des gants de protection.
Il est toxique pour la vie aquatique et génère des effets à long terme. Il doit être stocké dans des endroits où il n'y a pas d'accès au drainage ou au système d'égout. Il est très important de ne pas lui permettre d'être jeté dans l'environnement.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Manganèse sulfate. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume A22. VCH VERLAGSGELLSCHAFT MBH.
- OU.S. Bibliothèque nationale de médecine. (2019). Monohydrate de sulfate de manganèse. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Dunham, M.J. (2010). Guide de la génétique de Yast: génomique fonctionnelle, protéomique et autres systèmes Analyse des systèmes. Formulation moyenne. Dans les méthodes en enzymologie. Récupéré de ScienceDirect.com.
- Saric, m. et Lucchini, R. (2007). Manganèse. Tu utilises. Dans Handbook on the Toxicology of Metals (troisième édition). Récupéré de ScienceDirect.com.
- Vallero, D. (2014). Effets neurologiques des poluants aériens. Manganèse. En fonds de pollution atmosphérique (cinquième édition). Récupéré de ScienceDirect.com.
- Applaudir. (1986). In vitro Culture de Vite: Les effets du spectre léger sulfate de manganèse et d'iodure de potassium sur la morphogenèse. Cellule végétale, tissu et culte organique 7: 121-134 (1986). Lien récupéré.Springer.com.
- « Structure Secbutil, caractéristiques, nomenclature, formation
- +125 dictons courts et populaires [avec sens] »

