Sulfate de fer (feso4) Qu'est-ce que la structure, les propriétés, la synthèse
- 2438
- 533
- Raphaël Charles
Qu'est-ce que le sulfate de fer?
Il Sulfate de fer C'est un sel inorganique dont la formule chimique est feso4. Il se compose d'un solide cristallin d'une couleur variable, obtenu industriellement comme produit secondaire du traitement de l'acier.
Il se trouve dans la nature sous différentes formes, la plus courante étant le sulfate ferreux heptohydré, le feso4· 7h2O ("Vitriolo Verde", présent au minéral Melentiteritite). Cet hydrate se distingue facilement par la couleur vert bleu de ses cristaux. Les autres hydrates sont généralement feso4· XH2Ou, où x varie de 1 à 7.
L'heptahydrate de sulfate ferreux perd des molécules d'eau en raison du chauffage et peut être transformée en d'autres formes de sulfate ferreux; Ainsi, lorsque 57 ºC est chauffé, il perd trois molécules d'eau et se transforme en sulfate de tétrahydrate ferreux. Combien au total pouvez-vous perdre? Sept molécules d'eau, c'est-à-dire trop d'eau.
Le sulfate ferreux est utilisé dans le traitement et la prévention de l'anémie en fer. Cependant, il peut avoir des effets toxiques, vous devez donc être prudent dans votre dosage.
Structure de sulfate de fer
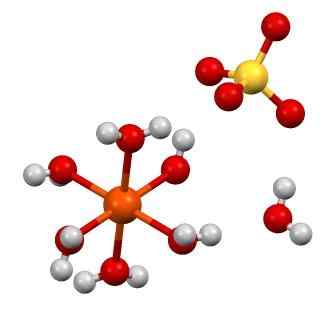
 Structure de feso4 · 7h2o. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Structure de feso4 · 7h2o. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Formule chimique de Feso4 Il souligne que ce sel est composé d'ions de foi2+ Et ainsi42- Dans une proportion 1: 1. Les deux ions interagissent à travers les forces électrostatiques de manière à ce qu'elles soient ordonnées dans un système cristallin ortorrombique; qui, logiquement, correspond au sel anhydre.
Dans l'image supérieure, en revanche, la structure du feso est montrée4· 7h2SOIT. La sphère orange représente le cation foi2+, Ce qui est apprécié, coordonne avec six molécules d'eau pour former un octaèdre. Le fardeau de la foi2+ attire l'anion alors42-, Et cela à son tour, s'il est observé, forment un pont d'hydrogène avec la septième molécule d'eau.
La septième molécule d'eau (celle qui est éloignée de l'octaèdre), forment également un autre pont d'hydrogène avec une autre molécule d'eau appartenant à un octaèdre voisin. Le résultat de ces interactions est que le verre passe de l'ortorrombique à la monoclinique.
Comme les cristaux de feso4 anhydre sont hydratants, les anions donc42- Autour de la foi2+ Ils sont remplacés par des molécules H2SOIT. Ces substitutions perturbent les électrons d de fer, les forçant à voyager à différents niveaux d'énergies; qui sont responsables des changements de coloration entre blanc, vert bleuâtre.
Peut vous servir: sulfite de sodium (NA2SO3)Proprietes physiques et chimiques
Des noms
Sulfate ferreux ou sulfate de fer (II)
Formule moléculaire
-Ferrroso anhydro sulfate (feso4)
-Heptahydrate sulfate ferreux (feso4.7h2SOIT)
Poids moléculaire
Varie avec le degré d'hydratation de sulfate. Par exemple, le sulfate de fer hépthydraté a un poids moléculaire de 278,02 g / mol; Tandis que l'anhydro a un poids moléculaire de 151,91 g / mol.
Apparence physique
Il varie également avec le degré d'hydratation. Par exemple, la forme anhydre présente des cristaux blancs ortorrombiques; Pendant la forme de l'heptahidra, les cristaux sont des monocliniques bleu-vert.
Odeur
Toilettes
Densité
Le sulfate ferreux asshidro est la forme de sel la plus dense (3,65 g / cm3). La forme heptahydrate, en revanche, est la moins dense (1 895 g / cm3).
Point de fusion
De même, cela varie en fonction du degré d'hydratation. La forme de l'anhydra a un point de fusion de 680 ºC (1.856 ºF, 973 K) et la forme heptahydrate, 60-64 ºC (140-147 ºF, 333-337 K).
Solubilité dans l'eau
-Formulaire monohydrata: 44,69 g / 100 ml d'eau (77 ºC)
-Forme heptahydrate 51,35 g / 100 ml d'eau (54 ºC).
Solubilité d'alcool
Insoluble.
La pression de vapeur
1,95 kPa (forme heptahydrate)
Indice de réfraction
1 591 (monohydrata) et 1 471 (heptahidrata).
La stabilité
Dans l'air, il peut s'oxyder rapidement et recouvert d'une couleur jaune-brun, ce qui indique la présence du cation foi3+. La vitesse d'oxydation est augmentée par l'ajout d'alcali ou par exposition à la lumière.
Décomposition
Lorsqu'il est chauffé à la décomposition, émet un dioxyde de soufre toxique et un trioxyde de soufre, laissant un oxyde de fer rougeâtre comme résidu.
Réactions
C'est un agent réducteur qui agit sur l'acide nitrique en le réduisant au monoxyde d'azote. De même, il réduit le chlore au chlorure, et les formes forxes toxiques présentes en ciment au chrome (iii), de moins de toxicité.
La synthèse
De la laine d'acier
Le sulfate ferreux est produit en réagissant en acier (foi) avec de l'acide sulfurique. Dans la méthode décrite, la procédure suivante est suivie: l'acier est utilisé sous la forme de la laine d'acier, qui est auparavant misérable avec de l'acétone.
Peut vous servir: chlorure ferreux (FECL2): structure, utilisations, propriétésEnsuite, la laine d'acier est placée dans un bécher en verre et est entièrement recouverte de 30 à 40% d'acide sulfurique, la digestion en acide se produit pendant plusieurs heures; Jusqu'à ce que la laine d'acier disparaît. Plus de laine d'acier peut être ajoutée et répétée la procédure plusieurs fois.
Les cristaux verts qui peuvent s'être formés sont redimencés en utilisant l'eau d'eau 1-2 avec de l'acide sulfurique. Cette solution est filtrée sur du papier filtre et le pH est ajusté en ajoutant du carbonate de sodium. La solution est enregistrée pour éviter le contact avec l'oxygène, et donc désavantager l'oxydation de la foi2+ à la foi3+
Par la suite, le filtrage est soumis à une évaporation à une température comprise entre 80 et 90 ºC. La procédure est effectuée dans des capsules Pietri placées sur une plaque de chauffage. Ensuite, les cristaux verts formés sont collectés, ce qui peut être emmené à un dessiccateur pour terminer leur déshydratation.
De la pyrite
Le sulfate ferreux pour l'oxydation de la pyrite est également produit (FES2).
2 fes2 + 7 o2 + 2 h2O => 2 feso4 + 2 h2Swin4
Des risques
L'inhalation du feso4 provoque l'irritation du nez, la gorge et les poumons. Si vous avez un contact physique avec ce sel, vous pouvez provoquer une irritation de la peau et des yeux; De plus, un contact prolongé avec ce dernier peut causer en eux un endroit brunâtre et des dommages aux yeux.
L'apport répété peut provoquer des nausées, des vomissements, des douleurs à l'estomac, une constipation et des mouvements intestinaux irréguliers.
Parmi les signes d'intoxication ferreux au sulfate, sont les suivants: excréments noirs ou sanglants; peau bleuâtre et ongles; changements dans le volume de l'urine excrétée; évanouissement; Dry ou yeux oraux; douleur pectorale; manger; difficulté respiratoire.
De plus, des battements rapides et irréguliers peuvent se produire, une augmentation de la soif et de la faim, de la pâleur inhabituelle et du raccourcissement de la respiration.
L'altération de la coagulation est une indication d'empoisonnement avec du sulfate ferreux, observant une extension de la thrombine, de la protrombine et du temps de la thromboplastine.
Des études sur l'effet du sulfate ferreux sur les muscles isolés du cœur des lapins nous ont permis d'observer qu'il a produit une réduction de la tension maximale développée par les muscles cardiaques étudiés, ainsi que la vitesse maximale de développement de tension.
Il peut vous servir: relation entre la chimie et la technologie avec l'être humain, la santé et l'environnementApplications
En agriculture
-Il est utilisé comme pesticide pour contrôler la pincée du blé et la décomposition des arbres fruitiers.
-Il est utilisé dans le traitement de la chlorose, une maladie caractérisée par la couleur jaunâtre des feuilles, causée par l'alcalinité des sols.
-Le sulfate ferreux contrôle l'alcalinité, réduisant le pH des sols.
- Élimine la mousse et conditionne la pelouse.
Comme réactif et dans l'industrie
Dans les utilisations du feso4 En tant que réactif et dans l'industrie, les suivants sont:
-Réactif analytique
-Matière brute pour obtenir de la ferrite et de l'oxyde de fer magnétique
-Ingrédient pour l'élaboration du pigment bleu inorganique
-Acide nitrique réactif, chlore et chrome
-Dans la fabrication d'autres sulfates
-Il est utilisé dans les bains de galvanoplastie avec du fer
-En bois
-Dans les gravures en aluminium
-Analyse qualitative du nitrate (test jaune marron par l'oxydation de la foi2+)
-Catalyseur de polymérisation
-Il est utilisé comme précurseur de la synthèse d'autres fers
-Il est utilisé industriellement comme fixateur de colorant
-Dans la fabrication de colorant en fer
-Mordant dans une coloration en laine
-Pour donner de la couleur argentée à Arce Wood
-Catalyseur de fer dans la réaction de Fenton
En médecine et pour la fortification des aliments
Il est utilisé dans le traitement de l'anémie en fer en fer, en utilisant une dose de 150 à 300 mg de sulfate ferreux, trois fois par jour, ce qui produit une augmentation perceptible de la concentration d'hémoglobine dans une semaine de traitement.
Son utilisation chez les femmes enceintes comme complément de leur alimentation a également été recommandée. Le sulfate ferreux a été utilisé comme astringent dans la guérison des plaies de bétail.
Autres
Il est utilisé dans le traitement des eaux usées par floculation et aussi pour l'élimination du phosphate de ces eaux. Le sulfate de hépthydrate ferreux est utilisé dans l'identification des types de champignons.
Les références
- Préparation en laboratoire du sulfate ferreux. Récupéré de: crscientific.com
- Hepthydrate de sulfate ferreux. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- « Sélection directionnelle qu'est-ce que, définition, exemples
- Les 4 coureurs de l'apocalypse et sa signification »

