Solvatation
- 3196
- 48
- Louna Baron
Quelle est la solvatation?
La Solvatation C'est l'union physique et chimique entre le soluté et les particules de solvant dans une solution. Il diffère du concept de solubilité dans le fait qu'il n'y a pas d'équilibre thermodynamique entre un solide et ses particules dissous.
Cette union est responsable des solides dissous "disparaissent" en vue des spectateurs; Quand en réalité, les particules deviennent très petites et finissent par "enveloppées" par des feuilles de molécules de solvant, ce qui les rend impossibles à les observer.

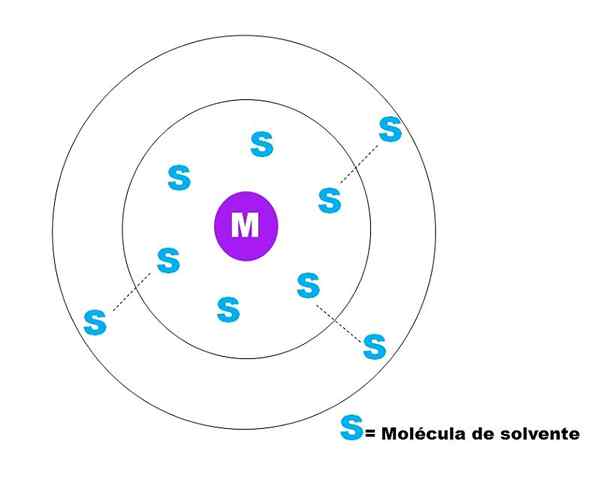
Dans l'image supérieure, un croquis très général de la solvatation d'une particule m est représenté. M peut être bien (m+) ou une molécule; Et s est la molécule de solvant, qui peut être n'importe quel composé à l'état liquide (bien qu'il puisse également être du gaz).
Notez que m est entouré de six s, qui composent ce que l'on appelle Sphère de solvatation primaire. D'autres molécules M à une distance plus élevée interagissent par les forces de van der Waals avec la première, formant une sphère de solvération secondaire, et ainsi de suite jusqu'à ce que toute commande soit évidente.
Processus de solvatation
 Source: Gabriel Bolívar
Source: Gabriel Bolívar Moléculairement, comment est le processus de solvatation? L'image supérieure résume les étapes nécessaires.
Les molécules de solvant, en bleu, sont initialement ordonnées d'interagir les unes avec les autres (S-S); Et les particules (ions ou molécules) du soluté, violet, font de même avec des interactions M-M fortes ou faibles.
Pour que la solvatation se produise, le solvant et le soluté doivent se développer (deuxième flèche noire) pour permettre des interactions de soluté-solvant (M-S).
Cela implique nécessairement une diminution des interactions de soluté-solvant et de solvant; diminuer qui nécessite de l'énergie, et par conséquent, cette première étape est endothermique.
Une fois le soluté et le solvant. Chaque cercle violet de la deuxième image peut être comparé à celui de la première image.
Peut vous servir: Calcium: propriétés, structure, obtenir, utiliserUn changement dans le degré d'ordre des particules peut être détaillé dans l'image; commandé au début, et désordonné à la fin. En conséquence, la dernière étape est exothermique, car la formation des nouvelles interactions stabilise toutes les particules de la solution.
Aspects énergétiques
Derrière le processus de solvatation, il existe de nombreux aspects énergétiques qui doivent être pris en compte. Premièrement: les interactions S-S, M-M et M-S.
Lorsque les interactions M-S, c'est-à-dire entre le soluté et le solvant, elles sont beaucoup supérieures (fortes et stables) par rapport à celles des composants individuels, il est question d'un processus de solvération exothermique; Et par conséquent, l'énergie est libérée dans l'environnement, qui peut être vérifiée en mesurant l'augmentation de la température avec un thermomètre.
Si, au contraire, les interactions M-M et S-S sont plus fortes que les M-S, alors «se dilater» aura besoin de plus d'énergie que celle qu'ils gagnent une fois que la solvatation a culminé.
Il y a alors à parler d'un processus de solvération endothermique. Étant ce cas, il y a une diminution de la température, ou ce qui est le même, l'environnement refroidit.
Il y a deux facteurs fondamentaux qui gouvernent si un soluté se dissout ou non dans un solvant. Le premier est le changement de solution de dissolution (ΔHDis), Comme expliqué, et le second est le changement d'entropie (ΔS) entre le soluté et le soluté dissous. Généralement, ΔS est associé à l'augmentation du trouble également mentionné ci-dessus.
Interactions intermoléculaires
Il a été mentionné que la solvatation est le résultat de l'union physique et chimique entre le soluté et le solvant; Cependant, comment sont exactement ces interactions ou syndicats?
Si le soluté est un ion, m+, Les interactions dites ion-dipolo sont produites (m+-S); Et s'il s'agit d'une molécule, il y aura des interactions dipol-dipolo ou des forces de dispersion de Londres.
Peut vous servir: Cyclohexane: structure, utilisations, conformationsLorsque vous parlez d'interactions dipolo-dipolo, il est dit qu'il y a un moment dipolaire permanent dans M et S. Ainsi, la région riche en électrons Δ- de M interagit avec la région pauvre de l'électron δ + de S. Le résultat de toutes ces interactions est la formation de plusieurs sphères de solvatation autour de m.
De plus, il existe d'autres types d'interactions: la coordination. Ici, les molécules de S de la forme de S les liaisons (ou dative) avec M, formant diverses géométries.
Une règle fondamentale pour mémoriser et prédire l'affinité entre le soluté et le solvant est: Égalité des dissous égaux. Par conséquent, les substances polaires se dissolvent avec une grande facilité dans les solvants également polaires; et les substances apolaires, se dissolvent dans les solvants apolaires.
Différences entre la solvatation et l'hydratation
 Source: Gabriel Bolívar
Source: Gabriel Bolívar En quoi le solvération de l'hydratation est-il différent? Les deux processus identiques, sauf parce que les S, de la première image, sont remplacés par ceux de l'eau, H-O-H.
Dans l'image supérieure, vous pouvez voir un cation m+ entouré de six molécules H2SOIT. Notez que les atomes d'oxygène (rouge) sont dirigés vers une charge positive, car il est le plus électronégatif et a donc la plus grande densité négative Δ-.
Derrière la première sphère d'hydratation, d'autres molécules d'eau sont regroupées par des ponts d'hydrogène (OH2-Oh2). Ce sont des interactions de type ion-dipolo. Cependant, les molécules d'eau peuvent également former des liaisons de coordination avec le centre positif, surtout s'il est métallique.
Ainsi, les célèbres aquocomplejos, m (oh2)n. Comme n = 6 dans l'image, les six molécules sont orientées autour de m dans un octaédre de coordination (la sphère interne d'hydratation). En fonction de la taille de m+, L'ampleur de sa charge et de sa disponibilité électronique, a déclaré que la sphère peut être plus petite ou plus grande.
Peut vous servir: oxyde chromé (III): structure, nomenclature, propriétés, utilisationsL'eau est peut-être le solvant le plus surprenant de tous: il dissout une quantité incommensurable de solutés, c'est un solvant trop polaire et a une constante diélectrique anormalement élevée (78 (78.5 k).
Exemples de solvération
Vous trouverez ci-dessous trois exemples de solvatation dans l'eau.
Chlorure de calcium
Lors de la dissolution du chlorure de calcium dans l'eau, la chaleur est libérée lorsque les cations CA sont résolues2+ et les anions CL-. La CA2+ Il est entouré d'un certain nombre de molécules d'eau égales ou supérieures à six (CA2+-Oh2).
Aussi, le CL- Il est entouré d'atomes d'hydrogène, la région Δ + de l'eau (Cl--H2SOIT). La chaleur libérée peut être utilisée pour la fusion des masses de glace.
Urée
Dans le cas de l'urée, c'est une molécule organique avec une structure H2N-co-nh2. Lors de la résolution, des molécules H2O Formez des ponts d'hydrogène avec les deux groupes d'amitié (-nh2-Oh2) et avec le groupe carbonyle (c = o- h2SOIT). Ces interactions sont responsables de leur grande solubilité dans l'eau.
De plus, sa dissolution est endothermique, c'est-à-dire qu'elle refroidit le récipient d'eau où il est ajouté.
Nitrate d'ammonium
Le nitrate d'ammonium, comme l'urée, est un soluté qui refroidit la dissolution après la solvatation de ses ions. Le NH4+ Solvata similaire à CA2+, Bien que probablement parce qu'il s'agit de la géométrie tétraédrique possède moins de molécules H2Ou autour de lui; Et non3- Solvata de la même manière que les anions CL- (Oh2-SOIT2Pas2SOIT).
Les références
- Whitten, Davis, Peck & Stanley. Chimie. (8e Ed.). Cengage Learning.
- Belford R. (s.F.). Processus de solvatation. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Guppy Surf. (s.F.). Le processus de solvatation. Récupéré de: SurfGupy.com

