Solution concentrée
- 3797
- 555
- Lucas Schneider
Qu'est-ce qu'une solution concentrée?
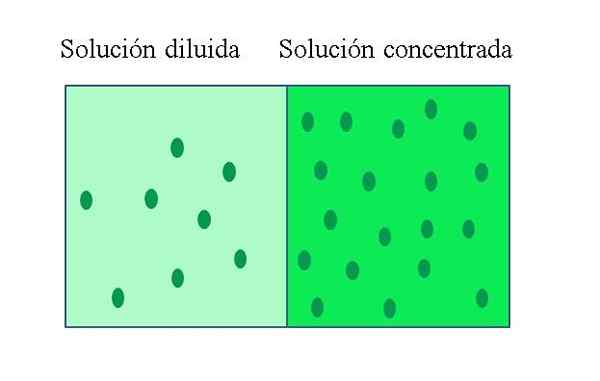
Ongle solution concentrée C'est celui qui contient une grande quantité de soluté par rapport à la quantité qu'il pourrait dissoudre. Au contraire, une solution diluée a une faible concentration de soluté. Une solution diluée peut être préparée à partir d'une solution concentrée en ajoutant du solvant, ou si possible, en extraction de soluté.
Le concept peut être relatif, car ce qui définit une solution concentrée sont les valeurs élevées dans certaines de ses propriétés; Par exemple, une meringue de mantecado a une forte concentration de sucre, qui est prouvé par sa saveur sucrée.
 Source: Gabriel Bolívar
Source: Gabriel Bolívar La concentration de soluté d'une solution concentrée est proche ou égale à celle existante dans une solution saturée. La principale caractéristique d'une solution saturée est qu'elle ne peut pas solubiliser une quantité supplémentaire de soluté à une certaine température. Par conséquent, la concentration du soluté dans ses solutions saturées reste constante.
La solubilité, de la plupart des solutés, augmente à mesure que la température augmente. De cette façon, vous pouvez solubiliser une quantité supplémentaire de soluté dans une solution saturée.
Ensuite, en diminuant la température, la concentration de soluté de la solution saturée augmente. Parler est ce cas d'une solution sursaturée.
Caractéristique d'une solution concentrée
La concentration d'une solution, c'est-à-dire la relation entre la quantité d'un soluté et la quantité d'une solution ou du solvant, peut être exprimée en pourcentage de soluté dans la solution (P / V ou P / P).
Il peut également être exprimé en taupes du soluté par litre de solution (molarité) et des équivalents de soluté par litre de solution (normalité).
Il est également courant d'exprimer la concentration d'une solution en moles de soluté par kilogramme du solvant (moléalité) ou de l'exprimer en moles d'un soluté par rapport aux moles totales de la solution (fraction molaire). Dans les solutions diluées, il est courant de trouver la concentration d'une solution en p.p.m. (parties par million).
Peut vous servir: Viscosité: exemples, causes, unités, typesQuelle que soit la forme d'expression de la concentration d'une solution, une solution concentrée a une proportion élevée du soluté, dans ce cas exprimée en masse, par rapport à la masse ou au volume de la solution ou du solvant. Étant cette concentration égale à la solubilité du soluté dans le solvant ou très proche de sa valeur.
Propriétés coligatives des solutions
Ils sont un ensemble de propriétés de solutions qui dépendent du nombre de particules dans la solution quel que soit son type.
Les propriétés coligatives ne font pas de discrimination entre les caractéristiques des particules, si elles sont du sodium, du chlore, du glucose, etc. L'important est votre numéro.
Pour ce fait, il était nécessaire de créer une manière différente d'exprimer la concentration d'une solution qui se rapporte aux propriétés coligatives si appelées. En réponse à cela, les expressions d'osmolarité et d'osmolalité ont été créées.
Osmolarité et osmolalité
L'osmolarité est liée à la molarité de la solution et de l'osmolalité avec sa moléalité.
Les unités d'osmolarité sont OSM / L d'une solution ou du mOSM / L de la solution. Alors que les unités d'osmolalité sont OSM / kg d'eau ou de mosm / kg d'eau.
Osmolarité = MVG
M = molarité de la solution.
v = nombre de particules dans lesquelles un composé en solution aqueuse se dissocie. Par exemple: pour NaCl, V a une valeur de 2; Pour le cacl2, V a une valeur de 3 et pour le composé non électrolytique du glucose, qui ne se dissocie pas, V a une valeur de 1.
g = coefficient osmotique, facteur de correction pour l'interaction des particules chargées électriquement en solution. Ce facteur de correction a une valeur proche de 1 pour les solutions diluées et tend à zéro à mesure que la molarité du composé électrolytique augmente.
Peut vous servir: mortier de laboratoire: caractéristiques, fonctions, utilisationsLes propriétés coligatives sont mentionnées ci-dessous, qui permettent de déterminer la quantité de solution concentrée.
Baisse de pression de vapeur
Lorsque l'eau est chauffée, s'évapore et la vapeur formée exerce une pression. À mesure que Soluto est ajouté, la pression de vapeur diminue.
Par conséquent, les solutions concentrées ont une faible pression de vapeur. L'explication est que les molécules de soluté se déplacent vers les molécules d'eau dans l'interface Agua-ate.
Point crioscopique diminuer
À mesure que l'osmolarité d'une solution augmente la température à laquelle la solution aqueuse est gelée. Si la température de congélation de l'eau pure est de 0º C, la température de congélation d'une solution aqueuse concentrée est inférieure à cette valeur.
Élévation du point d'embullition
Selon la loi de Raault, l'élévation du point d'ébullition du solvant pur est directement proportionnelle à la molarité de la solution qui provient de l'ajout de soluté. Par conséquent, les solutions concentrées ont un point d'ébullition plus élevé que l'eau.
Pression osmotique
Il y a deux compartiments avec des concentrations différentes, séparés par une membrane qui laisse passer l'eau, mais qui restreint le passage des particules de soluté.
L'eau s'écoulera de la solution qui a une concentration de soluté plus faible à la solution qui a une plus grande concentration de soluté.
Ce flux net d'eau disparaîtra lorsque l'eau accumulée dans le compartiment avec la concentration la plus élevée génère une pression hydrostatique qui s'oppose à l'écoulement de l'eau dans ce compartiment.
Il peut vous servir: diphénylamineLe débit d'eau par osmose se produit généralement vers des solutions concentrées.
Différences entre la solution concentrée et la solution diluée
-Les solutions concentrées ont une proportion de soluté élevée par rapport au volume ou à la masse de solution. Les solutions diluées ont une faible proportion de soluté par rapport au volume ou à la masse de la solution.
-Ils ont une molarité, une molélité et une normalité supérieures à celles présentées par les solutions diluées.
-Le point de congélation des solutions concentrées est inférieure à celle des solutions diluées; c'est-à-dire qu'ils gèlent à des températures plus froides.
-Une solution concentrée a moins de pression de vapeur qu'une solution diluée.
-Les solutions concentrées ont un point d'ébullition plus élevé que celui présenté par les solutions diluées.
-Contact à travers une membrane semi-perméable, l'eau s'écoulera des solutions diluées aux solutions concentrées.
Exemples de solutions
Concentré
-Le miel est une solution de sucre saturée. Il est courant d'observer l'occurrence de la recristallisation du sucre, comme en témoigne les tapas des récipients contenant du miel.
-L'eau de mer qui a une forte concentration de divers sels.
-Urine de personnes atteintes de déshydratation sévère.
-L'eau gazeuse est une solution de dioxyde de carbone saturé.
Dilué
-L'urine d'une personne avec une consommation d'eau excessive.
-La sueur est généralement une faible osmolarité.
-De nombreux médicaments fournis en solution ont une faible concentration.
Les références
- Wikipédia. Concentration. Récupéré de: est.Wikipédia.org
- Fusta L. Concentration des solutions: définition et niveaux. Étude. Récupéré de: étudier.com
- Solutions aqueuses - Mollarité. Récupéré de: Chem.Ucla.Édu
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.

