Haloid Sales Properties, Nomenclature, comment se forment-ils, exemples

- 3372
- 798
- Adam Mercier
Le Haloïdes Ce sont des composés binaires formés par un métal et un non-métal, sans aucun autre élément. Ces sels sont formés par la réaction de neutralisation entre un acide d'hydratie avec une base. Par exemple: la réaction entre l'acide chlorhydrique (HCL) avec l'hydroxyde de sodium (NaOH) pour former du chlorure de sodium (NaCl).
Les sels haloïdes sont également formés par la réaction d'une hydratie avec un métal. Par exemple: la réaction en magnésium avec l'acide chlorhydrique pour former du chlorure de magnésium (MGCL2). Comme on le voit, les chlorures sont les sels haloïdes les plus représentatifs. Cependant, ce ne sont pas les seuls.
 Halita, chlorure de sodium dans son état naturel, est l'exemple principal d'un sel haloïde. Source: http: // gl.Wikipédia.org / w / index.Php?Titre = utilisateur: Shinichi / Domaine public
Halita, chlorure de sodium dans son état naturel, est l'exemple principal d'un sel haloïde. Source: http: // gl.Wikipédia.org / w / index.Php?Titre = utilisateur: Shinichi / Domaine public Les sels de haloïde, selon certaines définitions, comprennent les composés qu'ils contiennent dans leur structure halogène; C'est-à-dire: fluor, chlore, brome et iode, ils sont donc considérés comme synonymes d'halogénures ou d'halogénuros.
De même, dans les sels de haloïde, sont inclus, par certains auteurs, des composés formés par l'union d'un métal avec un élément qui utilise sa valence négative, notamment: carbures, nitrures, phosphouros, sulfures, séléniuros, arseniuros, etc. Ceux-ci comptent également comme des sels de haloïde chaque fois qu'ils se composent de deux éléments.
[TOC]
Propriétés des ventes de haloïdes
Les sels haloïdes sont un groupe de composés dont les propriétés sont difficiles à établir.
Liens ioniques forts
En général, ils se composent de solides avec de fortes liaisons ioniques entre les ions de deux éléments: m+X-, où m+ correspond au cation métallique et x- l'anion dérivé de non-métal.
Points de fusion élevés, bouillir et sublimation
Ils ont généralement des points de fusion, d'ébullition et de sublimation très élevés, en raison précisément de la force de sa structure cristalline.
Il peut vous servir: DAPI (4 ', 6-Diamidino-2-Fenylindol): caractéristiques, fondation, utilisationConduction électrique
À l'état solide, ce sont de mauvais conducteurs d'électricité, mais en solution aqueuse lorsqu'ils sont ionisés, ou lorsqu'ils fusionnent, les bons conducteurs deviennent.
Apparence
Ce sont des solides cristallins qui, en poudre fragmentée, peuvent devenir une coloration blanche. Cependant, de nombreux sels de haloïde peuvent avoir une coloration différente. Par exemple, le chlorure de nickel est vert, tandis que le chlorure ferrique a une coloration oscillante entre le vert et le rouge.
Solubilité
La majorité des sels d'Haluros sont solubles dans l'eau, à l'exception de l'argent, du plomb (II) et des halogénures de mercure (i).
Odeur
Parce qu'ils ne sont pas des composés volatils, les sels de haloïde ne présentent pas de fortes odeurs. De plus, en raison de leur composition, ils peuvent être des saveurs aigre, salées, amères ou sucrées.
Nomenclature
Les sels de haloïde sont nommés en plaçant le nom de l'anion avec le suffixe aurochs, suivi directement du nom du métal, précédé par la conjonction de. Dans le cas où le métal a plus d'une valence, le métal est placé avec le suffixe ours ou ICO, Selon son Valencia.
Le nom du métal peut également être placé sans suffixe et avec le nombre d'oxydation entre parenthèses.
Par exemple: chlorure de fer (iii) ou chlorure ferrique, fecl3.
Comment se forment les sels de haloïde?
Les sels de haloïdes se forment principalement par trois réactions: neutralisation, réaction acide avec un métal et réaction d'un métal avec un métal ou un acteur non métallique avec une valence négative.
Réaction de neutralisation
C'est la réaction d'un acide avec une base, produisant du sel et une molécule d'eau. Par exemple:
HCl + NaOH → NaCl + H2SOIT
Cet exemple a été mentionné au prince.
Réaction d'un acide avec un métal
Un acide fort peut réagir avec un métal, originaire d'un sel et la libération d'hydrogène (H2). Par exemple: l'acide chlorhydrique réagit avec le zinc (Zn) pour former du chlorure de zinc (ZNCL2):
Peut vous servir: chimie analytiqueZn + HCl → Zncl2 + H2
Combinaison d'un métal avec un métal ou un non-métal
Ces sels de haloïde résultent de la combinaison d'un métal avec un métal ou un non-métal des halogènes. Par exemple: le phosphouro en aluminium combine le phosphore avec Valencia -3, avec de l'aluminium avec Valence +3. Maintenant, cette "combinaison" est due à des réactions de production spécifiques pour chaque sel.
Utilisations / applications
Halogénuros métalliques
Les halogénuros métalliques sont utilisés dans des lampes à haute intensité, comme les lampes modernes. Ils sont également utilisés dans les serres ou les climats de pluie pour compléter la lumière naturelle. Les halogénures d'argent sont utilisés dans les films et les papiers photographiques.
Chlorure de calcium
 Aspect du chlorure de calcium
Aspect du chlorure de calcium Le chlorure de calcium est utilisé comme source de calcium dans le traitement des eaux usées. Il est également utilisé comme source de calcium à travers son électrolyse. Il est utilisé dans le traitement des arythmies cardiaques et en cas d'hypocalcémie sévère.
Chlorure ferrique
Le chlorure ferrique est utilisé dans le traitement des eaux usées et la purification de l'eau. Il est également utilisé pour enregistrer ou opter pour le cuivre et intervenir comme catalyseur dans le processus de synthèse du chlorure de vinyle.
Chlorure et bromure de potassium
Le chlorure de potassium est utilisé comme engrais et dans le traitement de l'hypokaliémie ou de l'hypokaliémie. Le bromure de potassium, en revanche, a été utilisé comme anticonvulsif et est actuellement utilisé dans l'industrie pharmaceutique et comme pansement.
Chlorure et sulfure de sodium
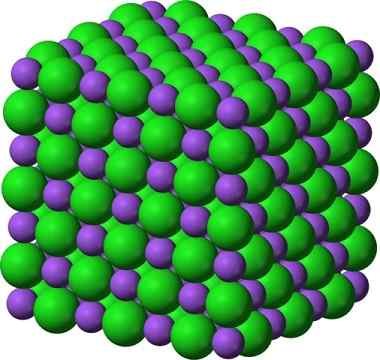
 La structure cristalline du chlorure de sodium, NaCl, un composé ionique typique. Les __ sphères violettes représentent des cations sodium, Na + et les __ sphères vertes représentent le chlorure des anciens, Cl−.
La structure cristalline du chlorure de sodium, NaCl, un composé ionique typique. Les __ sphères violettes représentent des cations sodium, Na + et les __ sphères vertes représentent le chlorure des anciens, Cl−. Le chlorure de sodium est utilisé comme saveur alimentaire, dans la conservation de la viande, comme antiseptique, dans une hyponatrémie sévère, etc. Le sulfure de sodium est utilisé dans les réacteurs nucléaires dans la production d'eau lourde, dans l'élimination des poils de la peau et dans la fabrication de caoutchoucs, de colorants et de peintures.
Peut vous servir: oxyde d'aluminium: structure, propriétés, utilisations, nomenclaturePhosphouros et nituros
Le phosphouro en aluminium est utilisé comme semi-conducteur à large bande et comme insecticide. Pendant ce temps, Gallium Nitruro est utilisé comme semi-conducteur.
Exemples de sels de haloïde
Outre les exemples mentionnés dans la section précédente, d'autres sels de haloïde avec leurs formules et noms respectifs:
-NaCl: chlorure de sodium
-KCL: chlorure de potassium
-Cacl2: Chlorure de calcium
-MGCL2: Chlorure de magnésium
-CSCL: chlorure de césium
-Bacl2: Chlorure de baryum
-Fecl2: Chlorure ferreux
-Fecl3: Chlorure ferrique
-NICL2: Chlorure de nickel
-CUCL: chlorure de cuprous
-Cucl2: Chlorure cuprique
-AGCL: chlorure d'argent
-Zncl2: Chlorure de zinc
-Cdcl2: Chlorure de cadmium
-HGCL2: Chlorure mercurique
-ALCL3: Chlorure d'aluminium
-NABR: bromure de sodium
-KBR: bromure de potassium
-CSBR: bromure de césium
-CDBR: bromure de cadmium
-Mgbr2: Bromure de magnésium
-Srbr2: Bromure de strontium (II)
-Ki: Yoduro au potassium
-NAI: iodure de sodium
-CSI: césium yoduro
-Ali3: Iodure d'aluminium
-PIB2: Iodure de plomb (II)
-NAF: fluorure de sodium
-LIF: fluorure de lithium
-Caf2: Fluorure de calcium
-PTF2: Fluorure de platine (II)
-Nas2: Sulfure de sodium
-Li4C: Carbure de lithium
-Mg2C: Carbure de magnésium
-ALP: phosphouro en aluminium
-Ouais3N4: Silicon nitruro
-Étain: titane nitruro
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Julián Pérez Porto et María Merino. (2016). Définition des sels de haloïde. Définition.de. Récupéré de: Définition.de
- James P. Bouleau. (5 juin 2019). Halogées. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Wikipédia. (2020). Halogénure. Récupéré de: dans.Wikipédia.org
- « Properties de peroxydes, nomenclature, utilisations, exemples
- Caractéristiques du thermomohigomètre, fonctions, pièces, utilisations »

