Formule de base des sels, propriétés, nomenclature, exemples

- 4680
- 122
- Prof Ines Gaillard
Le sels de base Ce sont tous ceux qui se dissolvent dans l'eau génèrent des solutions avec des valeurs de pH supérieures à 7. Ceci s'explique par la formation oh ion-, qui proviennent directement du processus de dissolution ou de l'équilibre d'hydrolyse lorsque l'anion participe.
Les sels de base contiennent un anion oh- Dans leurs solides. Par exemple, les hydroxydes alcalins, tels que le sodium et le potassium, NaOH et KOH, sont considérés comme membres de ces sels; Bien qu'ils soient extrêmement caustiques, c'est pourquoi ils méritent la dénomination des hydroxydes au lieu d'être appelés sels.
 L'hydroxyde de sodium est un exemple de sel de base
L'hydroxyde de sodium est un exemple de sel de base D'autres sels de base ont plutôt des anions tels que le carbonate, le CO32-. Le carbonate dérive de l'acide carbonique, h2CO3, Un acide faible. Par conséquent, les sels de carbonate, tels que le carbonate de calcium utilisé dans les antiacides, sont classés comme sels de base. Le même raisonnement s'applique au bicarbonate de sodium, NAHCO3, Et pour tous les autres sels de bicarbonate.
Les sels de base sont importants car plusieurs d'entre eux aident à neutraliser l'acidité alimentaire. Ils peuvent également être utilisés pour préparer des solutions d'amortissement au pH alcalin.
[TOC]
Définitions
Les sels de base ont deux définitions qui se complètent: ils contiennent des anions OH- Dans leurs solides, ou générer ces mêmes anions hydroxillis une fois que leurs cristaux se dissolvent dans l'eau.
Quelle que soit la définition choisie, le pH de ses solutions aqueuses sera supérieure à 7, et donc ils seront alcalins ou basiques.
Formule générale des sels de base
Clarifié ce qui est compris par le sel de base, sa formule, bien que non strictement générale, est la suivante:
Mn(OH)WXoV
Où m est le cation métallique ou ammonium, oh les hydroxils, et xo l'anion dérivé d'un acide faible ou fort. Les indices n, W et V Combien de m, oh et xo, respectivement, composent le sel de base, ainsi que leurs proportions.
Noter que V Il peut être égal à zéro, ce qui signifie que nous avons un hydroxyde alcalin ou alcalinoterreo. C'est ce qui se passe avec Naoh et Koh. De même, W Cela peut être zéro, ce qui signifie qu'il n'y a pas d'ions oh-. Par exemple, le caco3 Il n'a pas oh-, Et pourtant, il reste un sel de base.
Peut vous servir: sulfure de calcium (CAS): structure, propriétés, obtention, utilisationsDe ce qui précède, il est conclu que la formule générale des sels de base est mn(OH)WXoV, Mais tous les sels ne sont pas conformes à cela. Par conséquent, un facteur plus important à prendre en compte est la nature de l'anion XO. Ainsi, on sait quand un sel est basique, qu'il ait ou non des ions oh ou non- Dans leurs formules.
Propriétés de base des sels
Les sels de base se dissolvent dans l'eau suivant l'équation suivante:
Mn(OH)WXoV(s) → nM+(AC) + WOh-(AC) + VXo-(AC)
Notez que lorsqu'il dissout les libères ions oh- dans l'eau. Cela affecte le pH de la solution, devenant alcalin avec une valeur supérieure à 7. Par exemple, le nitrate de calcium de base se dissout dans l'eau en fonction de la façon dont il suit:
Ca (oh) Non3(s) → CA2+(Ac) + oh-(ac) + non3-(AC)
Les valeurs de n, W et V Ils sont égaux à 1 pour ce sel.
D'un autre côté, les sels de base qui n'ont pas oh-, Mais un anion dérivé d'un acide faible est hydrolysé dans l'eau:
Voleur3(s) → CA2+(AC) + CO32-(AC)
CO32-(AC) + H2Ou (l) ⇌ HCO3-(Ac) + oh-(AC)
Notez que le produit de cette hydrolyse est un anion OH-. De là se trouve l'alcalinité de ces bases. Cependant, et comme prévu, ils sont moins basiques que ceux qui ont déjà les ions oh- présent dans leurs cristaux. Par exemple, Naoh est extrêmement basique:
NaOH (S) → Na+(Ac) + oh-(AC)
Eh bien, libérez les ions oh- directement dès que l'eau touche; Ou pire, touche à peine l'humidité de la peau.
Peut vous servir: carbocation: formation, caractéristiques, types, stabilitéD'autres propriétés physiques ou chimiques des sels de base ne diffèrent pas trop de celles des autres sels neutres ou acides.
Nomenclature
La nomenclature des sels de base dépend de la nature de l'anion xo: s'il est monoatomique, ou s'il s'agit d'un oxoanion. Cependant, cette section se concentrera spécialement sur les sels de base avec des anions OH-. Ceux qui ne les ont pas ont des nomenclatures beaucoup plus faciles à mémoriser ou à raisonner.
Avec des anions monoatomiques
Les anions monoatomiques ne sont pas représentés comme xo, mais comme x. Ils dérivent d'un hydraceide HX, comme l'acide fluorure, le HF ou l'acide chlorhydrique, le HCl, etc.
Dans ces cas, ils sont systématiquement nommés de deux manières:
(Préfixe numérique sauf le singe) Nom de l'anion hydroxi + se terminant par le suffixe -Uro + nom du métal avec sa valence entre parenthèses (s'il en a plus d'un)
Par exemple, le sel Ni (OH) CL est appelé hydroxychlorure de nickel (II).
Nom de l'anion avec terminaison -Uro + - (préfixe numérique sauf singe) Hydroxyde + nom de métal et sa valence entre parenthèses
Par exemple, Salt Ni (OH) CL peut également être nommé comme chlorure de nickel-hydroxyde (II).
Nous avons également la nomenclature traditionnelle, parfois mélangée avec le systématique:
Nom de l'anion suivi de (préfixe numérique sauf le singe) de base et le nom du métal avec les suffixes -ooso ou -ico comme appliqué.
Par exemple, le Ni (OH) CL est appelé chlorure de base en nickel, ou chlorure de nickel de base (II).
Avec des oxoanions
La nomenclature systématique des sels de base qui ont des oxoanions est un peu plus compliquée. Cependant, la version la plus simple est construite comme suit:
(Préfixe numérique) Hydroxyde- (nom d'anion) + du nom de métal et son Valencia entre parenthèses
Par exemple, foi (oh) non3 est appelé: nitrate d'hydroxyde-fer (II).
Il a également la nomenclature traditionnelle:
NION NION + (Préfixe numérique) Nom + Nom du métal se terminant par -oso ou -ico
Peut vous servir: Oxygène: propriétés, structure, risques, utilisationsAinsi, la foi (oh) non3 Il est appelé: nitrate de base ferreux ou nitrate de fer de base (II).
Entraînement
Les sels de base sont le produit de neutralisations acide-base, en particulier entre une hydratie ou un oxoacide avec un excès de base ou d'hydroxyde:
Base (excès) + acide → sel de base ou alcalin + eau
Par exemple, ca (oh) non3 Il est formé en neutralisant l'acide nitrique avec un excès d'hydroxyde de calcium:
Ca (oh)2(Excès) + HNO3 → Ca (oh) Non3 + H2SOIT
Une autre formation de formation serait la suivante:
Foi (OH)3(Excès) + h2Swin4 → Fe (oh) donc4 + 2h2SOIT
Ce sel est appelé: sulfate ferrique de base, sulfate de fer de base (III) ou hydroxyde de fer-sulfate (III).
Exemples de sels de base
 Les antiacides, tels que le carbonate de calcium, CACO3, sont des exemples de sels de base. Source: Pixabay.
Les antiacides, tels que le carbonate de calcium, CACO3, sont des exemples de sels de base. Source: Pixabay. Enfin, certains autres exemples de sels de base seront répertoriés avec leurs noms plus simples:
-Nach3COO: acétate de sodium
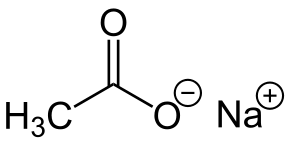 L'acétate de sodium
L'acétate de sodium -N / A2S: sulfure de sodium
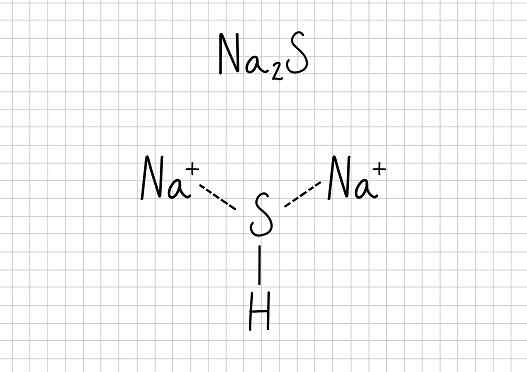 Sulfure de sodium
Sulfure de sodium -KCN: cyanure de potassium
-MGCO3: carbonate de magnésium
-Foi (oh) donc3: Sulfite de fer de base (III)
-Foi (oh) (c6H5Roucouler)2: Benzoate de fer de base (III)
-AUCL (OH)2: Chlorure de dibasique or (III)
-Cuclo3(OH): Chlorate de cuivre de base (II)
-À (oh) donc4: Sulfate de base en aluminium
-PB (OH)2CO3: Carbonate de plomb dibasique (IV)
Le problème des sels de base est que tous ne peuvent pas être préparés, car un excès de base ou d'hydroxyde n'est pas suffisant pour les cristalliser sans recourir à d'autres processus. C'est le cas de PB (OH)2CO3. Cependant, ce carbonate existe sous forme de pigment de plomb blanc (ii), dont la formule est de 2pbco3· PB (OH)2 ou PB3(OH)2(CO3)2.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Sel alcalin. Récupéré de: dans.Wikipédia.org
- Wu c., Dowell C. & Hooper n. (1er juillet 2014). Propriétés acides des sels. Récupéré de: Chem.Bibliothèque.org
- Nicola McDougal. (2020). Solutions de sel acide et basique: explication et exemple. Étude. Récupéré de: étudier.com
- Problème et exercices chimiques. (s.F.). Sels de base. Récupéré de:.est
- « Concept et exemples de structure matérielle
- Caractéristiques de la fonction échelonnée, exemples, exercices »

