Règle de Markovnikov
- 1567
- 121
- Eva Henry
Quelle est la règle de Markovnikov?
La Règle de Markovnikov Il s'agit d'une règle empirique, formulée en 1869 par le chimiste russe Vladimir Markovnikov, qui est utilisé pour prédire la régiosélectivité des produits d'un ajout électrophile. Même aujourd'hui, il est toujours en vigueur, révélant sa simplicité dans la façon dont le mécanisme de plusieurs réactions organiques vient.
Cette règle s'applique particulièrement aux alcènes dans leurs réactions d'hydrohalogénation. Ainsi, il permet de prédire quels seront les produits majoritaires lorsque les alcènes et les alcynes réagiront avec HX (HF, HCL, HBR et HI).
 Appréciation de la règle de Markovnikov dans l'hydrohalogénation de la propeno. Source: V8RIK, CC BY-SA 3.0, via Wikimedia Commons
Appréciation de la règle de Markovnikov dans l'hydrohalogénation de la propeno. Source: V8RIK, CC BY-SA 3.0, via Wikimedia Commons Supposons par exemple l'hydrobromation du propeno ou du propylène (image supérieure). La règle de Markovnikov prédit que le produit majoritaire sera celui dans lequel l'atome de brome est lié au carbone du centre; Pendant que dans le produit mineur, le brome se retrouve jusqu'au carbone à double liaison.
Notez que le produit majoritaire a l'atome d'hydrogène lié au carbone terminal. Ce dernier point est le plus facile à mémoriser: l'hydrogène HX va au carbone de la double liaison qui a plus d'hydrogène ou de liaisons C-H.
Principes du Règle de Markovnikov
Ajout électrophile
Aux doubles liaisons d'alcènes ou d'alkines. Le HX a un mauvais atome d'électrons, qui est H, et un atome riche en électrons, qui est x.
Par conséquent, Hx peut être représenté comme Hδ+-Xδ-, Être la région Hδ+ susceptible de recevoir des électrons, dans ce cas, à double liaison d'un alcène, qui se déroule l'attaque électrophylique (voir l'image ci-dessous).
Peut vous servir: acide phénylacétique: structure, propriétés, utilisations, effetsStabilité de la carbocation
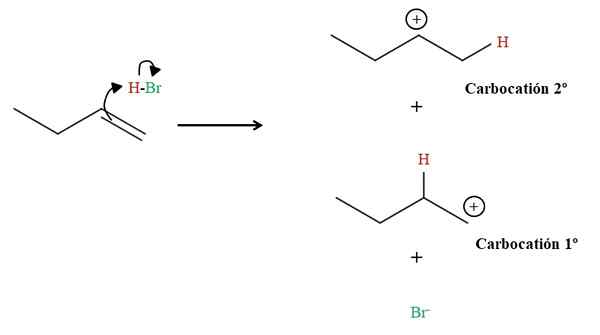
 Formation des deux carbocations dans la coincement du 1-Butène. Source: Gabriel Bolívar via Molview.
Formation des deux carbocations dans la coincement du 1-Butène. Source: Gabriel Bolívar via Molview. Comme on peut le voir ci-dessus, la double liaison à 1-butène attaque l'hydrogène HBO. Ce faisant, les électrons de la liaison H-Br "Open" vers l'atome de brome, formant un carbocation et l'anion Br-. Cependant, il y a la possibilité de former deux carbocations: l'une (1er) et l'autre secondaire (2e).
Chaque carbocation est un composé intermédiaire à partir duquel le produit final dérivera. Lorsqu'il y a deux carbocations, nous aurons alors deux produits: 2 bromobutano et 1 bromobutano. Le BR- Il agit comme un nucléophique attaquant l'une ou l'autre des deux carbocations:
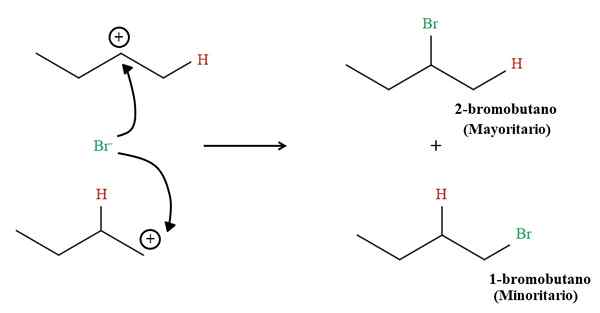 Produits d'hydrobromation à 1-Butène. Source: Gabriel Bolívar via Molview.
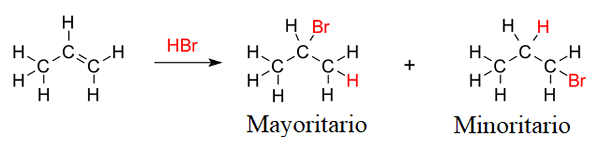
Produits d'hydrobromation à 1-Butène. Source: Gabriel Bolívar via Molview. Mais la proportion des deux produits n'est pas de 50%; Le 2-bromobutano se produit beaucoup plus grand que le 1-bromobutane.
La raison en est que la 2e carbocation est plus stable que la 1ère carbocation, car sa charge positive est mieux stabilisée par les atomes de carbone adjacents; Pendant que dans le carbocation 1, l'atome d'hydrogène ne contribue pas presque aucune densité électronique à cette charge positive (être pour l'induction ou l'hyperconjugation).
Les riches deviennent plus riches
La règle de Markovnikov est née des observations finales, et d'eux les mécanismes illustrés ci-dessus pourraient être considérés pour les expliquer.
Sans avoir besoin de toujours capturer ces mécanismes, ou de déduire la stabilité des carbocations intermédiaires, la règle simple est utilisée: dans une addition électrophile, les atomes d'hydrogène sont dirigés vers le double carbone avec le double avec plus d'atomes d'hydrogène. Ainsi, le carbone le plus hydrogéné devient encore plus hydrogéné.
Peut vous servir: quelles sont les anomalies de l'eau?D'un autre côté, l'atome x, dans ce cas le BR, se termine par le carbone de la double liaison qui a plus de liaisons C-C, ou qui est plus remplacée par d'autres atomes qui ne sont pas de l'hydrogène. Parce que dans le 1-Butène, son carbone terminal est = CHO2, C'est celui qui reçoit l'hydrogène pour se transformer en groupe -ch3.
Exemples
Le cas de la règle de Markovnikov appliquée dans la réaction d'hydrobromation a été observé ci-dessus. Il est également valable pour les réactions d'hydrocloclinisation, d'hydroiodation, d'hydroamination et d'hydratation, soit pour les alcènes ou les alkines.
Dans la section suivante, certains exemples supplémentaires seront considérés comme des exercices.
Exercices résolus
Exercice 1
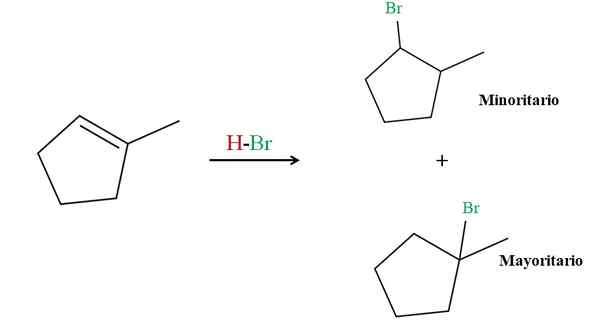 Hydrobromation du 2-méthylciclopentène. Source: Gabriel Bolívar via Molview.
Hydrobromation du 2-méthylciclopentène. Source: Gabriel Bolívar via Molview. La règle de Markovnikov indique que le HBR H pour la réaction supérieure doit aller au carbone à double liaison avec plus d'atomes d'hydrogène. Dans ce cas, il correspond au carbone ci-dessus, puisque le carbone à droite, lié à Cho3, Il n'a même pas d'atomes d'hydrogène.
Ainsi, l'hydrogène HBR va au carbone au-dessus, tandis que le BR se retrouve lié au carbone à droite (produit majoritaire). D'un autre côté, si l'hydrogène est lié au carbone à droite, le BR est dirigé vers le carbone au-dessus (produit moindre).
Notez que le produit majoritaire se compose d'un 3e halogénure, plus stable par définition et les effets de stabilisation des charges positives partielles; Alors que le produit minoritaire est un 2ème halogche moins stable.
Les deux produits, la majorité et le moindre. Ce type de produit minoritaire, contre la règle de Markovnikov, est connu sous le nom de produit antimarkovnikov.
Peut vous servir: Électrode de référence: caractéristiques, fonction, exemplesExercice 2
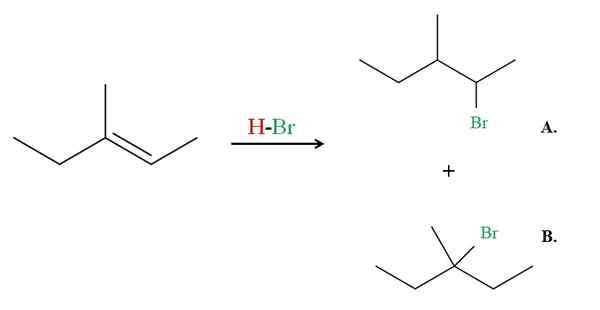 Hydrobromation du 3-méthyl-2-pentène. Source: Gabriel Bolívar via Molview.
Hydrobromation du 3-méthyl-2-pentène. Source: Gabriel Bolívar via Molview. Voir maintenant l'exemple du 3-méthyl-2-pentène.
S'il est observé, le carbone droit de la double liaison a un H, tandis que celui à gauche. Par conséquent, le H du HBR ira à ce carbone, le carbone doit aller au centre pour provoquer le produit B. Le produit B est la majorité, car encore une fois, c'est un 3e halogée, le produit étant un Haluro 2e.
Exercice 3
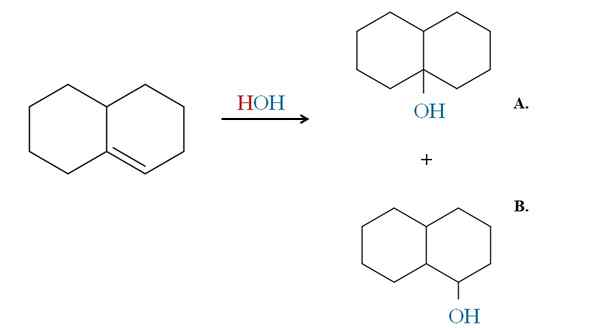 Exemple de la règle de Markovnikov dans l'hydratation d'un alcène cyclique. Source: Gabriel Bolívar via Molview.
Exemple de la règle de Markovnikov dans l'hydratation d'un alcène cyclique. Source: Gabriel Bolívar via Molview. Les exemples précédents auraient généré les mêmes produits si au lieu de HBR était utilisé HCl et HI. Il en va de même que avec H2O Dans une réaction d'hydratation catalysée par l'acide et la chaleur. Oh vient remplacer l'atome HX.
Par conséquent, la règle de Markovnikov nous dit que dans l'ajout électrophile ci-dessus, OH ira au carbone de la double liaison la plus remplacée, avec moins d'hydrogène.
Ainsi, le produit A est la majorité et le produit b la minorité. Notez à nouveau que le produit A est un 3ème alcool et le produit B A 2ème alcool.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). La règle de Markovnikov. Récupéré de: dans.Wikipédia.org
- Steven A. Hardinger. (2017). Glossaire illustré de la chimie organique: la règle de Markovnikov. Récupéré de: Chem.Ucla.Édu
- Gamini Gunawardena. (24 août 2020). La règle de Markovnikov. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Les éditeurs d'Enyclopaedia Britannica. (17 septembre 2013). La règle de Markovnikov. Récupéré de: Britannica.com
- Docteur. S. Gevorg. (2020). Chimie organique: la règle de Markovnikov avec des problèmes de pratique. Récupéré de: ChemistRoySteps.com

