Chaleur de combustion

- 3374
- 2
- Lucas Schneider
Quelle est la chaleur de la combustion?
Il Chaleur de combustion C'est l'énergie libérée lorsqu'une certaine quantité de matériau, généralement une mol, réagit de manière exothermique avec l'oxygène de l'air. Il s'agit d'une propriété de thermochimie essentielle dans la caractérisation des carburants, des alcools et, en particulier, des hydrocarbures, comme le butane et le méthane.
Lorsqu'une substance brûle la lumière et la chaleur, l'énergie qui peut être utilisée pour travailler sur d'autres corps. Par exemple, la chaleur générée est capable de chauffer de grands volumes d'eau, dont la vapeur presse l'environnement, agissant certains générateurs électriques; ou simplement, réchauffer les aliments cuits à la vapeur.
 La chaleur générée par la combustion du gaz de cuisine est utilisée pour chauffer les chaudrons et les aliments
La chaleur générée par la combustion du gaz de cuisine est utilisée pour chauffer les chaudrons et les aliments La chaleur de combustion varie entre toutes les substances, même si sa nature chimique est essentiellement la même. Cette variation correspond à une stabilité relative, c'est-à-dire: plus un composé est instable, plus l'énergie libérée est grande, représentée comme -ΔH. Le symbole négatif signifie que la chaleur s'écoule.
Différentes valeurs -ΔH sont utilisées pour comparer la stabilité relative entre différents Alkaus et leurs isomères. Il lui permet également d'être stable.
La mesure
Pour mesurer les chaleurs de combustion, une pompe calorimétrique est nécessaire. En lui, la substance réagit avec l'oxygène par l'activation d'une étincelle électrique.
Ensuite, la chaleur libérée chauffe un volume d'eau qui entoure le compartiment d'échantillon, mesurant la température avant et après la combustion, ainsi que la masse d'eau et de carburant.
Ainsi, l'énergie libérée sera égale à:
Ceh2o·mH2Ou · Δt
Oùeh2o C'est la chaleur spécifique de l'eau, 4.184 J / G · ºC, mH2Ou la masse de l'eau, et Δt son changement de température. Enfin, cette chaleur, exprimée en joule ou en unités de calories, est divisée entre la masse ou les moles du carburant placé à l'intérieur de la pompe calorimétrique, pour obtenir la chaleur de combustion par unité de masse ou de moles.
Peut vous servir: quel est l'équivalent mécanique de la chaleur?Les métaux ne se combinent pas, mais oxydent à différentes vitesses en fonction de la température à laquelle ils sont exposés. La chaleur qu'ils produisent est méprisable pour être mesurée de la même manière qu'elle est faite avec les hydrocarbures et autres carburants. Ce ne sont donc pas des substances combustibles.
Énergies potentielles
Pendant la combustion, les liens sont rompus pour en former de nouveaux, plus stables. L'énergie contenue dans toutes les liaisons molécules est indépendante de son mouvement, il y a donc une énergie potentielle.
Plus l'énergie potentielle est grande, plus la molécule sera instable et, par conséquent, il libérera plus de chaleur une fois les nouveaux liens établis.
Pour savoir exactement quels sont ces nouveaux liens, les produits d'une combustion complète doivent être pris en compte: CO2 Pour le carbone, h2Ou pour l'hydrogène, et non2 Pour l'azote. En ce qui concerne les hydrocarbures, leur combustion complète générera des mélanges stoechiométriques de CO2 et h2SOIT.
Les deux molécules, CO2 et h2Ou, ils ont des énergies potentielles très faibles, car leurs liens (O = C = O et H-O-H) sont très stables par rapport aux liens d'hydrocarbures à partir desquels ils sont venus (C-H et C-C).
Stabilité relative
Les énergies potentielles sont librement. Mais leurs variations ne sont pas, c'est-à-dire la différence de ces énergies entre les produits (CO2 et h2O) et réactifs (hydrocarbures).
C'est pourquoi ayant ces variations, ou ce qui est la même chose, leurs chaleurs de combustion, vous pouvez savoir quelle est la stabilité relative entre un ensemble d'hydrocarbures ou d'isomères.
Se ferme
Les alcanes peuvent être linéaires, ramifiés ou cycliques. Dans le cas des alcanes linéaires, sa chaleur de combustion varie en fonction de la longueur de ses chaînes; c'est-à-dire que cela dépend du nombre d'unités ch2 ont. Considérer l'exemple de n-hexane, n-heptano et n-octane:
Il peut vous servir: iode: historique, propriétés, structure, obtention, risques, utilisationsCh3(Ch2)4Ch3, -ΔH = 4163 kJ / mol
Ch3(Ch2)5Ch3, -ΔH = 4817 kJ / mol
Ch3(Ch2)6Ch3, -ΔH = 5471 kJ / mol
Vous pouvez voir que ses chaleurs de combustion varient de 654 kJ / mol. Cela signifie que chaque cho2 qui est ajouté à la chaîne augmente la chaleur de combustion à un taux de 654 kJ / mol. Ainsi, le nonano, ch3(Ch2)7Ch3, Il aura une chaleur de combustion égale à 6125 kJ / mol (5471 kJ / mol + 654 kJ / mol).
C'est la même chose que de dire que les chaînes plus longues ont des énergies potentielles plus importantes, et par conséquent, ils sont plus instables.
Les alcanes ramifiés sont plus stables que linéaires, et cela est déduit de leurs chaleurs de combustion. Considérez maintenant le cas de trois isomères de l'octane:
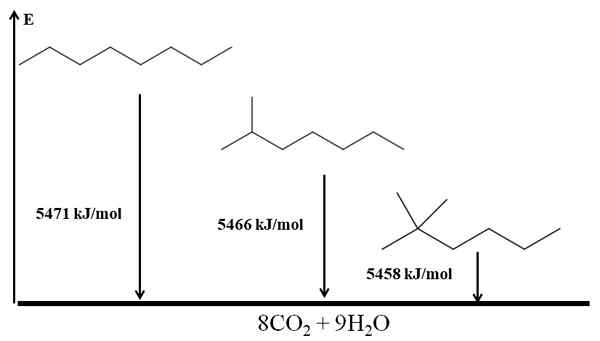 Chauffes de combustion pour trois isomères d'octane. Source: Gabriel Bolívar via Molview.
Chauffes de combustion pour trois isomères d'octane. Source: Gabriel Bolívar via Molview. Il n-Octano est le plus instable car sa chaleur de combustion est la plus grande (5471 kJ / mol). D'un autre côté, les isomères 2-méthylheptano et 2.2-diméthylhexan. Le 2.2-diméthylhexan est le plus stable pour être le plus ramifié des trois isomères.
Alcènes
La stabilité relative des alcènes peut également être obtenue à partir de leurs chaleurs de combustion. Considérez, par exemple, quatre isomères Buttenus:
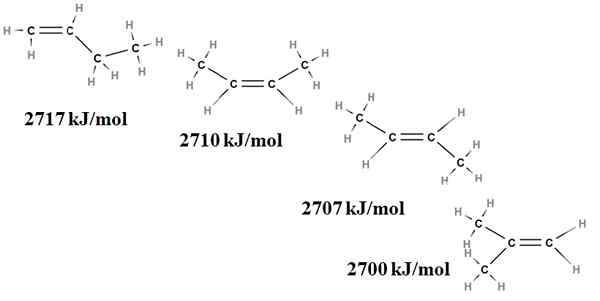 Chauffement de combustion pour les isomères Buteno. Source: Gabriel Bolívar via Molview.
Chauffement de combustion pour les isomères Buteno. Source: Gabriel Bolívar via Molview. Ici, nous ne parlons plus de ramifications, mais du degré de remplacement de la double liaison, C = C, et de ses tensions Van der Waals; c'est-à-dire des répulsions électroniques et stériques entre deux groupes volumineux situés du même côté de la double liaison.
Le premier isomère, 1-Butène, est le plus instable car sa double liaison est moins remplacée (H2C = c). Cela se reflète dans sa chaleur de combustion de 2717 kJ / mol.
Peut vous servir: acide chlorogéniqueÀ droite, le CIS-2-Butene, est un peu plus stable car sa double liaison est plus remplacée. Mais le trans-2-butène l'est encore plus, car même s'il a le même degré de substitution, les groupes sont confrontés3 de la double liaison est en position trans, c'est-à-dire de différents côtés de la double liaison. Notez que la chaleur du trans-2-butène (2707 kJ / mol) est à peine un peu inférieure à celle du cis-2-butène (2710 kJ / mol).
Le dernier isomère, le 2-méthyl-2-butène, qui est également également remplacé que le CIS et le Trans 2 Bungeo, est néanmoins le plus instable de tous. C'est parce que les deux ch3 Ils se trouvent dans l'un des carbones de la double liaison, étant donc un alcène avec Cho3 Géminales.
Composés carbonyle
Ainsi que les alkos et les autres hydrocarbures en général, la stabilité relative des composés carbonyle (cétones, aldéhydes, acides carboxyliques) sont également liées à leurs chaleurs de combustion.
Ainsi, les plus stabilisés ou moins réactifs c = o, les mineurs seront leurs chaleurs de combustion.
Par exemple, la chaleur de la combustion du butanal, ch3Ch2Ch2Cho, c'est 2475 kJ / mol. Cette chaleur est supérieure à la 2-butanone, ch3Ch2Coch3, qui est égal à 2442 kJ / mol. Par conséquent, Butanal est plus instable que la 2-butanone.
Dans le 2-butanone, le C = O est plus stabilisé grâce aux groupes ch3Ch2 et ch3; Chose qui ne se produit pas avec le butan, où l'un des groupes est à peine un atome h.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Chaleur de combustion. Récupéré de: dans.Wikipédia.org
- Fondation CK-12. Chaleur de combustion. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- BBC. (2020). Énergie chimique: enthalpie de combustion. Récupéré de: BBC.co.ROYAUME-UNI
- Steven A. Hardinger. (2017). Glossaire illustré de la chimie organique: enthalpie de combustion. Récupéré de: Chem.Ucla.Édu

