Règle de puits ou multiplicité maximale
- 1254
- 265
- Lucas Schneider
Nous expliquons quelle est la règle ou le principe de la multiplicité maximale, les étapes pour l'appliquer et donner plusieurs exemples
 Source: Gabriel Bolívar
Source: Gabriel Bolívar Quelle est la règle du puits?
La Règle, Également appelé principe de multiplicité maximal du spin, c'est une règle empirique qui est utilisée pour écrire la configuration électronique absolue des éléments chimiques lorsqu'ils sont dans leur état fondamental. C'est-à-dire que c'est une règle qui aide à prédire comment les électrons sont distribués dans les orbitales atomiques d'un atome qui est assoupli ou à son niveau d'énergie le plus bas.
La règle de Sink dit:
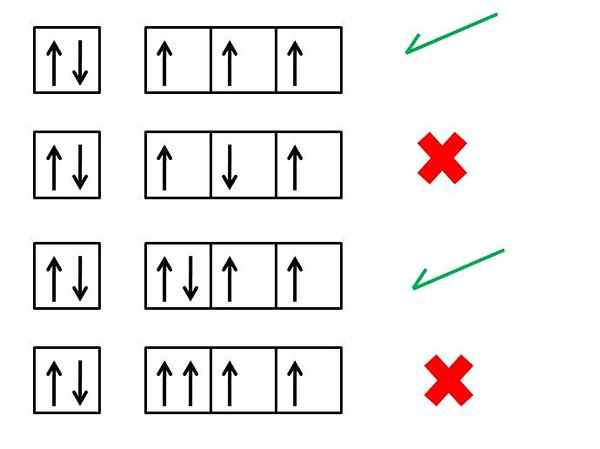
"... Dans un atome qui est dans son état fondamental, les électrons du même niveau d'énergie seront distribués de manière à ce qu'il y ait autant que possible des épines parallèles".
Cette règle correspond à l'un des principes fondamentaux de la mécanique quantique et de la théorie atomique actuelle. Il est très utile de comprendre certaines propriétés des différents éléments, en particulier leurs propriétés magnétiques. En effet, les atomes sont attirés ou repoussés par des aimants car ils ont disparu des électrons dans leur structure.
D'où vient la règle de multiplicité du couler ou une maximum?
Spectres atomiques
Ce principe a d'abord énoncé le physicien allemand Friedrich Hund en 1927. Évier a étudié les spectres d'absorption atomique, qui permettent de mesurer expérimentalement l'énergie que les électrons absorbent lorsqu'elles sont exposées au rayonnement électromagnétique d'une longueur d'onde adéquate. Les observations expérimentales ne peuvent être expliquées que si l'atome possédait autant d'électrons que possible avec le même tour.
Électrons manquants
En plus des spectres atomiques, il existe d'autres observations expérimentales qui confirment les configurations électroniques prédites en appliquant la règle Hund. Le plus important consiste en les mesures expérimentales des propriétés magnétiques des atomes qui permettent de déterminer combien d'électrons manquants ont un atome.
Il peut vous servir: électrolyse de l'eauLes électrons manquants sont ceux qui sont seuls dans une orbitale, sans leur couple de spin opposé respectif.
Étapes pour appliquer la règle du puits
La règle du puits s'applique lorsque nous écrivons la configuration électronique d'un atome dans son état fondamental. Cela signifie qu'il s'agit d'une règle complémentaire d'autres règles, telles que le principe Aufbau ou le principe de construction (également appelé la règle de la pluie) et le principe d'exclusion de Pauli.
S'applique uniquement aux cas dans lesquels nous voulons.
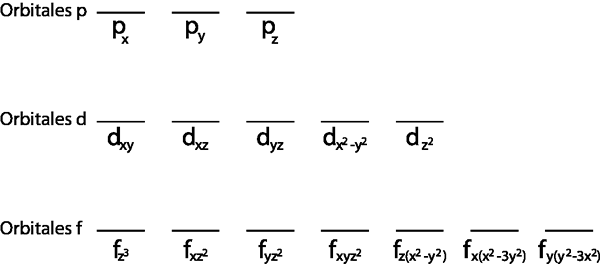
De plus, il est logique de l'appliquer pour la couche de Valence, c'est-à-dire ce niveau d'énergie incomplet (il n'a pas tous les électrons qui s'y trouvent). Sinon, tous les électrons seraient jumelés pour se conformer au principe d'exclusion de Pauli.
L'application de cette règle se compose des étapes suivantes:
- Étape 1: Tracez une ligne horizontale ou un petit rectangle pour chaque orbitale du sous-niveau.
- Étape 2: Placez le premier électron dans la première orbitale avec votre spin pointant vers le haut.
- Étape 3: Placer l'électron suivant dans la prochaine orbitale, pointant également vers le haut.
- Étape 4: Continuez comme ça jusqu'à ce que les électrons soient terminés ou qu'il n'y a plus d'orbitales vides.
- Étape 5: Si lorsque vous placez un électron dans chaque orbitale, il reste des électrons à distribuer, répétez les étapes 2 à 4 mais plaçant les électrons avec leur spin vers le bas.
Pour comprendre comment ces étapes s'appliquent, analysons quelques exemples.
Exemple 1: Configuration électronique azote
L'azote est l'élément numéro 7, il a donc un total de 7 électrons tournant autour du noyau. Ces électrons sont distribués comme suit, suivant la règle de la pluie:
Peut vous servir: acétanylide (C8H9NO)12 2s2 2 P3
Comme nous pouvons le voir, la couche de valence azote correspond au niveau 2 d'énergie (appelé couche L) dans laquelle 8 électrons s'adaptent. Cependant, l'azote n'a que 5 électrons de valence.
Dans les orbitales s Seuls 2 électrons s'adaptent, donc l'orbitale 2S est complètement pleine et n'a aucun sens d'appliquer la règle du puits pour cette orbitale.
D'un autre côté, le sous-niveau 2p, qui contient 3 orbitales, n'est pas plein. Mais comment ces 3 électrons sont-ils distribués dans ces trois orbitales? Ils sont distribués en suivant les étapes de la règle du puits, qui sont présentées ci-dessous:
Étape 1: Tracez une ligne horizontale ou un petit rectangle pour chaque orbitale du sous-niveau.
Comme c'est le sous-niveau 2p, il y a trois orbitales qui sont les 2pX, 2 Pet et le 2Pz. Nous devons donc dessiner trois rayures horizontales ou trois boîtes ou rectangles:
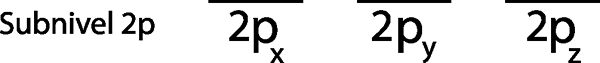
Chacune de ces rayures ou cases représente une orbitale, comme indiqué par le nom qui a chuté chacun d'eux.
Étape 2: Placez le premier électron dans la première orbitale avec votre spin pointant vers le haut.
Nous plaçons le premier électron dans l'orbital 2pX Puisque c'est la première orbitale de la liste.
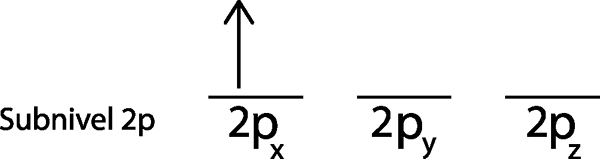
Étape 3: Placer l'électron suivant dans la prochaine orbitale, pointant également vers le haut.
Le deuxième électron est situé dans l'orbital 2pet
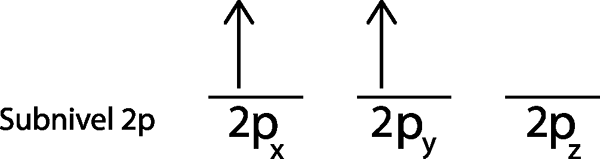
Étape 4: Continuez comme ça jusqu'à ce que les électrons soient terminés ou qu'il n'y a plus d'orbitales vides.
Dans notre cas, nous devons simplement distribuer 3 électrons, nous avons donc juste besoin de placer le dernier électron dans la dernière orbitale et le tour est joué:
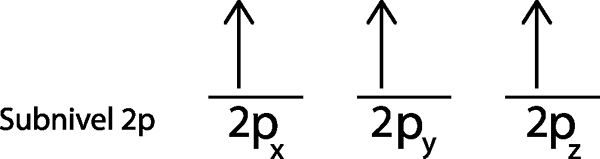
Comme on peut le voir, le principe de la multiplicité maximale ou de la règle du puits prédit que l'azote atomique doit avoir 3 électrons manquants.
Peut vous servir: oxydes d'azote (NOx)Dans ce cas, il n'était pas nécessaire d'appliquer l'étape 5, car après l'étape 4, nous avons été laissés sans électrons pour distribuer.
Exemple 2: Configuration électronique en fer
Le fer est l'élément 26 et sa configuration électronique est:
12 2s2 2 P6 3s2 3p6 3D6 4s2
Dans ce cas, nous pouvons noter que l'orbital avec le niveau d'énergie le plus élevé est de 4S, mais parce qu'il s'agit d'un métal de transition, le fer a une orbitale partiellement pleine. C'est l'orbital dont nous distribuerons les électrons en suivant la règle Hund.
Étape 1: Tracez une ligne horizontale ou un petit rectangle pour chaque orbitale du sous-niveau.
Nous remplirons le sous-niveau 3D qui contient 5 orbitales:
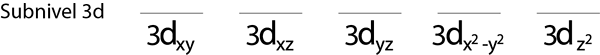
Étape 2: Placez le premier électron dans la première orbitale avec votre spin pointant vers le haut.
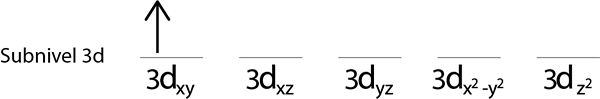
Étapes 3: Placer l'électron suivant dans l'orbitale suivant, pointant également vers le haut.
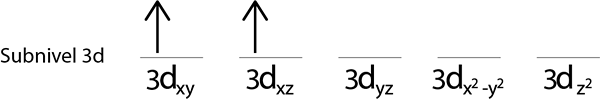
Étape 4: Continuez comme ça jusqu'à ce que les électrons soient terminés ou qu'il n'y a plus d'orbitales vides.
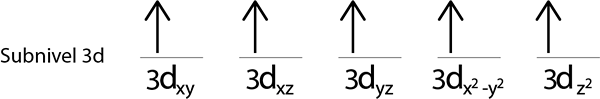
Étape 5: Si lorsque vous placez un électron dans chaque orbitale, il reste des électrons à distribuer, répétez les étapes 2 à 4 mais plaçant les électrons avec leur spin vers le bas.
Comme nous avons encore un électron à distribuer après avoir placé un électron dans chaque orbitale 3D, le dernier des 6 électrons est placé avec le rotation opposée dans la première orbitale.
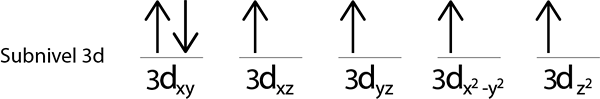
C'est la configuration absolue d'un atome de fer dans son état fondamental. Dans le même, le fer a 4 électrons manquants avec des épines parallèles.
Les références
- Sans réponse Questions sur la règle maximale de multiplicité ou de puits: ce qui devrait être fait (2020). Tiré de la physis andquimica.com.
- Évier - chimie (2021). Tiré de CostProject.org.
- Multiplicité maximale de Sind (2020). Tiré de Principode.com.
- Règle du puits | The Chemistry Guide (2012). Tiré de la chimie.Laguia2000.com.

