Élément chimique
- 1501
- 102
- Raphaël Meyer
Nous expliquons ce qu'est un élément chimique, ses propriétés, les types qui existent, et nous donnons plusieurs exemples
 Un élément chimique est un composant qui ne peut pas être divisé et possède des propriétés uniques autres que tout autre matériau existant
Un élément chimique est un composant qui ne peut pas être divisé et possède des propriétés uniques autres que tout autre matériau existant Qu'est-ce qu'un élément chimique?
UN élément chimique Il peut être défini comme une question ou un composant qui ne peut pas être divisé et qui a des propriétés uniques autres que tout autre matériau existant. Selon les caractéristiques de chaque élément, ils peuvent être plus ou moins rares et précieux.
Pour qu'un élément chimique soit défini comme tel, il doit répondre à la caractéristique d'être indivisible. C'est-à-dire qu'il ne peut pas être décomposé en plus petites portions. Ces parties qui ne peuvent plus être divisées sont ce que l'on appelle les atomes.
Certains des éléments chimiques peuvent partager des composés en commun, ce qui le rend proche et relationne entre ces. Cependant, ils ont de nombreuses autres parties qui ne partagent pas avec d'autres éléments se définissant ainsi que.
Ces matériaux chimiques peuvent être à l'état solide ou gazeux et se trouvent dans différents endroits et environnements autour de la planète. Même des études scientifiques ont trouvé ces types de substances dans des éléments externes à la Terre, comme les astéroïdes ou d'autres planètes éloignées.
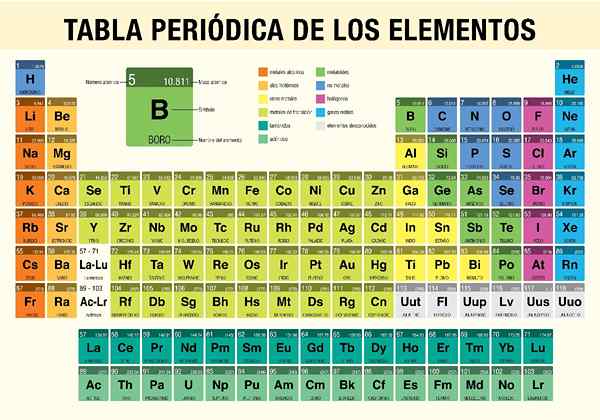
118 éléments chimiques sont actuellement connus et sont organisés en fonction de leur nombre d'atomes et de caractéristiques dans ce que l'on appelle table périodique.
Types d'éléments chimiques
De nature, les éléments chimiques définis ci-dessus peuvent être trouvés; Cependant, beaucoup d'entre eux peuvent être purs ou devraient rejoindre d'autres pour former de nouveaux matériaux chimiques, donnant ainsi naissance à la classification de ces composés.
Parmi les types d'éléments chimiques, il existe quatre grands groupes, qui seront expliqués ci-dessous. Cependant, il existe d'autres sous-groupes plus spécifiques de ce type d'éléments qui seront également exposés.
Les métaux
Ce sont des composants qui sont principalement à l'état solide et en raison de leurs propriétés, ils sont de très bons conducteurs de chaleur et d'électricité. De plus, ce sont des éléments qui ont une luminosité caractéristique, qui varie son intensité selon chaque sujet.
Peut vous servir: quel est l'équivalent mécanique de la chaleur?Les substances classées comme métaux sont également caractérisées par le fait d'être très gérable et ductile, leur permettant ainsi de transformer ou de rejoindre facilement d'autres éléments chimiques.
Dans les éléments métalliques, il y a six sous-groupes qui sont:
- Actinides
- Lantanides
- Métaux de transition
- Alcalin
- Alcalin-terreos
- Autres métaux.
Pas de métaux
Ces composants sont principalement à l'état solide; Malgré cela, ils diffèrent des métaux, car ils ne sont pas de bons conducteurs de chaleur ou d'électricité et n'ont pas la luminosité caractéristique de ce dernier.
De plus, ce sont des composants qui n'ont pas la ductilité et la manipulation facile des métaux, donc les transformer est un processus beaucoup plus complexe.
Métalloïdes
On peut dire que ces composants sont une combinaison entre les éléments métalliques et non métalliques, partageant les caractéristiques des deux groupes. Certains d'entre eux permettent en partie la conduction de l'électricité et de la chaleur et leur ductilité peut être plus grande ou moindre, selon l'élément chimique.
gaz nobles
Ce sont des matériaux chimiques trouvés dans la nature à l'état gazeux et sont des composants avec des caractéristiques très spéciales et différents de tout autre élément gazeux existant.
Ces éléments sont considérés comme assez stables et ne font pas de modifications ou de réactions chimiques avec d'autres éléments pour créer de nouvelles substances.
Propriétés périodiques
Comme mentionné ci-dessus, tous les éléments chimiques existants sont classés comme ce que l'on appelle un tableau périodique. Ce tableau n'est rien d'autre qu'un schéma organisé qui place par des groupes (verticalement) et des périodes (horizontalement) chacun des sujets chimiques en fonction de leurs caractéristiques.
Étant clair sur le tableau périodique, les propriétés périodiques peuvent alors être définies. Ces derniers sont ces caractéristiques ou particularités qui définissent chaque élément chimique et établissent à leur tour leur emplacement dans le tableau périodique.
Peut vous servir: carbone amorphe: qu'est-ce que les types, les propriétés, les utilisationsIl existe quatre principales propriétés périodiques:
Électronégativité
Cette propriété peut être définie comme la capacité d'une composante chimique particulière d'attirer ou de lier à d'autres éléments chimiques. En d'autres termes, l'électronégativité est la force que les atomes d'un composant spécifique ont, pour attirer les atomes d'un autre élément.
Dans le tableau périodique, les éléments qui augmentent son électronégativité sont situés de gauche à droite dans les périodes et dans les groupes ascendants.
Radio atomique
La propriété radio atomique n'est rien de plus que la référence à la taille des atomes qui composent chaque élément chimique. C'est-à-dire que chaque sujet a un certain nombre d'atomes avec différentes tailles.
Dans le tableau périodique, ils sont situés de haut en bas à mesure que la taille du rayon atomique augmente dans les groupes et dans les périodes diminue.
Affinité ou structure électronique
Cette propriété peut être définie comme le changement d'énergie qu'un élément obtient dans sa structure atomique en ayant un certain changement dans le même.
Dans le tableau périodique, ils sont situés dans le même groupe, car ils ont en commun cette structure atomique.
Potentiel d'ionisation
Cela fait référence à l'énergie requise par la structure atomique d'un élément particulier pour modifier son statut.
Dans le tableau périodique, sa classification est donnée dans un groupe en diminuant de haut en bas et dans les périodes augmentant de gauche à droite.
Il existe d'autres propriétés périodiques secondaires telles que l'électropositivité, la densité atomique, le volume atomique, la température de fusion et la température d'ébullition.
Peut vous servir: concentration chimiqueExemples d'éléments chimiques
Comme mentionné, il y a actuellement 118 éléments chimiques identifiés. Ces éléments ont un nom et un symbole uniques qui les identifient non seulement dans le tableau périodique mais aussi dans le domaine scientifique de la chimie.
Ensuite, 50 de ces éléments seront présentés avec leurs noms et symboles d'identification, qui font partie des quatre types d'éléments mentionnés ci-dessus.
- Oxygène (O)
- Fluorure (f)
- Néon (NE)
- Sodium (NA)
- Magnésium (mg)
- Aluminium (AL)
- Silicium (oui)
- Phosphore (p)
- Soufre (s)
- Chlore (CL)
- Xenón (Xe)
- Cesio (CS)
- Barium (BA)
- Lantano (LA)
- Cerio (CE)
- Prasodimio (PR)
- Néodimium (ND)
- ProMetio (PM)
- Samario (SM)
- Europio (UE)
- Renio (Re)
- Osmio (OS)
- Ididio (ir)
- Platine (PT)
- Or (AU)
- Mercure (HG)
- Talio (TL)
- Plomb (PB)
- Bismuth (BI)
- Polonio (PO)
- Astato (AT)
- Radon (RN)
- Francio (FR)
- Radio (RA)
- Actio (AC)
- Torio (th)
- Protacinium (PA)
- Uranium (u)
- Neptunio (NP)
- Plutonium (PU)
- Dubnium (DB)
- Selorgio (SG)
- Bohrio (BH)
- Hassio (HS)
- Meitnerio (MT)
- Darmstatio (ds)
- Roentgenio (RG)
- Copernicio (CN)
- Flerovio (FL)
- Livermoorio (LV)
Les références
- Boule, p. (2019). Qu'est-ce qu'un élément? Obtenu à partir de Chemistryworld.com
- Tableau périodique (2018). Obtenu à partir de RSC.org
- Tableau périodique des éléments (2019). Obtenu à partir de pubchem.NCBI.NLM.NIH.Gouvernement
- Tableau périodique des éléments (2018). Obtenu auprès de Sigmaaldrich.com
- Quelles arations? (2020). Obtenu à partir de la BBC.co.ROYAUME-UNI

