Caractéristiques et exemples de réaction irréversibles
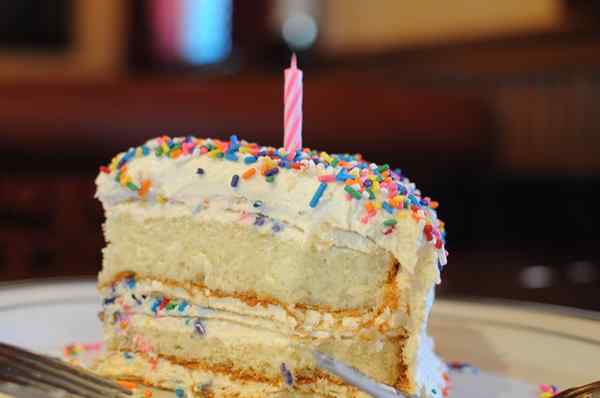
- 980
- 44
- Louna Baron
Ongle Réaction irréversible C'est celui qui n'atteint pratiquement pas l'état d'équilibre et, par conséquent, tous les réactifs sont devenus des produits. On dit qu'il se produit dans une direction: de gauche à droite, car les produits ne peuvent pas recombrer pour provenir à nouveau les réactifs.
Aujourd'hui, il existe plusieurs théories et angles dont l'irréversibilité d'une réaction chimique peut être expliquée. La vision la plus simple est de prendre en compte la façon dont les réactifs sont instables, la stabilité des produits, ou si des gaz ou des solides se forment qui s'échappent ou séparés du milieu de réaction.

Les réactions irréversibles sont très courantes. Si nous voyons des changements dans notre environnement dans lesquels inverser ses effets, il était nécessaire de retirer le temps, alors ce type de réactions chimiques sera sûrement. Par exemple, un gâteau seul ne reviendra pas à son état initial: les ingrédients.
Cependant, les produits d'une réaction irréversible peuvent subir des réactions qui en font des réactifs. C'est le cas des herbes, qui traitées avec de forts agents réducteurs peuvent récupérer le fer métallique contenu en eux.
[TOC]
Caractéristiques des réactions irréversibles
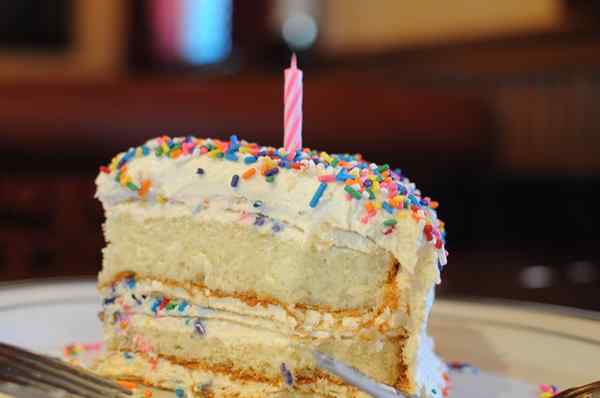 La préparation d'un gâteau ou d'un gâteau comprend un grand nombre de réactions irréversibles qui se développent simultanément. Source: pxhere.
La préparation d'un gâteau ou d'un gâteau comprend un grand nombre de réactions irréversibles qui se développent simultanément. Source: pxhere. Équation chimique générale
Toute réaction irréversible peut être représentée par une simple équation chimique, en supposant que deux espèces réactives participent, A et B:
A + b => c + d
A et b réaction de manière irréversible pour se transformer en c et d. Il n'y a pas de place pour un équilibre à établir. Ce qui a réagi ne se régénère pas, et ce qui n'est pas, restera en excès en raison de la performance de la réaction elle-même, ou parce que l'un des réactifs a été consommé.
Peut vous servir: Orcein: fondation et préparationNotez qu'ils ne sont pas spécifiés dans quel état d'agrégation chaque réactif ou produit est localisé (solide, gaz ou liquide).
Il y a des réactions où une quantité méprisable de C et D, en raison de leur nature chimique, se recombins pour se régénérer et b. Si cela se produit en équilibre, il est dit qu'il est très déplacé vers la droite; c'est-à-dire vers la formation de produits.
Ce n'est que dans ces cas qu'il n'y a aucune sécurité d'affirmer qu'une réaction présumée est sans aucun doute irréversible. Cependant, une telle situation ne se produit généralement pas régulièrement dans les réactions qui présentent des changements trop notables.
Des modifications chimiques
Ce n'est pas une règle générale ou définitive, mais plusieurs des réactions irréversibles génèrent des changements chimiques remarquables. Par exemple, des réactions très exothermiques sont considérées dans une essence irréversible, en raison de la quantité d'énergie sous forme de chaleur et de lumière qui est libérée.
Le même raisonnement s'applique lorsque nous observons l'apparence d'un gaz, soit bouillonnant le sein du liquide, soit en suinter les pores d'un solide. Si ce gaz s'échappe du moyen de réaction, il sera impossible de participer à l'établissement de l'équilibre; c'est-à-dire qu'il ne réagira pas à régénérer aucun des réactifs.
De même, la formation d'un solide ou d'un précipité implique dans l'acte que la réaction est irréversible, car seule sa surface aura toujours un contact avec le milieu de réaction. Et si ce solide a une structure très stable, beaucoup moins participera à un équilibre (autre que sa solubilité), car ses particules seront confinées.
D'un autre côté, vous ne pouvez pas toujours faire confiance aux changements de couleur. De nombreuses réactions où elles sont réellement appréciées, et tôt ou tard le changement est inversé.
Peut vous servir: Bromide au lithium: structure, propriétés, utilisations, risquesProduits stables et réactifs instables
Une caractéristique plus généralisée des réactions irréversibles est que les produits formés sont beaucoup plus stables que les réactifs participants à la réaction. Cela explique pourquoi C et D ne veulent plus "se recombiner pour se régénérer et b, car ces derniers sont des espèces plus instables.
Cette stabilité peut être prédite en connaissant les structures des produits, à quel point les nouvelles liaisons sont fortes et stables, voire à travers un mécanisme moléculaire qui montre les étapes consécutives d'une réaction.
Réversibilité apparente
Il y a des réactions irréversibles qui nécessiteraient pratiquement du temps pour se retirer afin que les réactifs se forment à nouveau. Ou plus que des réactions, ce seraient des changements ou des processus qui impliquent une série d'entre eux. C'est parce qu'il ne s'agit pas d'inverser une réaction, mais beaucoup et instantanément. Par exemple: la décomposition des fruits.
D'autres réactions irréversibles au contraire peuvent être inversées si leurs produits réagissent avec d'autres espèces. Il y a aussi des réactions qui se produisent dans une "version inverse" à travers différents processus ou mécanismes. L'exemple le plus connu est celui de la respiration cellulaire et de la photosynthèse, différenciant que le dernier profite de l'énergie solaire.
Exemples
Certains exemples représentatifs de réactions irréversibles seront mentionnés ci-dessous.
Oxydation
Importe lorsque l'oxydation le fait de manière irréversible, sauf si elle entre en contact avec les agents réducteurs. Les métaux lorsqu'ils sont oxydés apparaissent à sa surface une couche d'oxyde, qui est déposée avec l'humidité et le dioxyde de carbone, en plus des sels, un processus de corrosion commence.
L'oxyde métallique ne sera pas en désintégration.
Combustions
Toutes les matières organiques qui réagissent vigoureusement avec l'oxygène, subiront une combustion et se détacheront des oxydes gazeux et cendres. Ces oxydes, par essence co2, H2OU NON2 Et ainsi2, Ils ne se recombineront jamais pour donner naissance aux molécules initiales. C'est le cas des plastiques, des hydrocarbures, du bois, des plants et des matières animales.
Il peut vous servir: salicylate de méthyleNeutralisation à base d'acide solide
Lorsqu'un acide et une base forts réagissent ou neutralisent, les espèces générées ne se rétablissent pas pour les générer. Par exemple, NaOH et HCL réagissent pour produire du NaCl et H2Ou, à la fois des espèces très stables:
NaOH + HCl => NaCl + H2SOIT
Cette réaction est irréversible, il est inutile où il a été vérifié qu'une partie du NaOH ou du HCL a régénéré. Il en va de même pour d'autres paires d'acides et de fortes bases.
Dissolution du métal
Métaux lors de la dissolution dans des acides forts un sel, de l'eau et du gaz se forment. Par exemple, le cuivre est attaqué par l'acide nitrique pour donner du cuivre, de l'eau et du dioxyde d'azote:
Cu + 4hno3 => Cu (non3)2 + 2h2O + 2NO2
La solution résultante a une couleur bleuâtre, et jamais par magie réapparaîtra les particules cuivrées, indiquant la formation de cuivre métallique.
Saponification
Enfin, nous avons la réaction de saponification, qui est irréversible; Bien que plusieurs de ses étapes internes soient réversibles. Les savons d'origine ne deviendront pas les graisses à partir desquelles ils procédaient; Même l'hydroxyde de potassium, Koh, une base aussi forte, ne peut être régénéré par n'importe quelle action de bilan.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- BBC. (2020). Qu'est-ce qui est irréversible? Récupéré de: BBC.co.ROYAUME-UNI
- Académie Khan. (2020). Réactions chimiques. Récupéré de: Khanacademy.org
- Fait monstre. (2020). DK Science: réactions chimiques. Récupéré de: factmonster.com
- Ginesa Blanco. (16 octobre 2019). Est-il vrai qu'aucune réaction chimique n'est irréversible? Le pays. Récupéré de: Elpais.com
- « Caractéristiques et exemples de réaction réversibles
- Formule minimale Comment supprimer la formule minimale, des exemples et des exercices »

