Formule minimale Comment supprimer la formule minimale, des exemples et des exercices
- 1996
- 359
- Raphaël Charles
La Formule minimale ou empirique C'est une expression de la proportion dans laquelle les atomes des différents éléments qui forment un composé chimique sont présents. La formule minimale est donc la représentation la plus simple d'un composé chimique. À cela est dû au «minimum».
La formule minimale n'exprime pas les nombres d'atomes des différents éléments qui forment un composé chimique; mais la proportion dans laquelle ces atomes sont combinés pour générer le composé chimique.
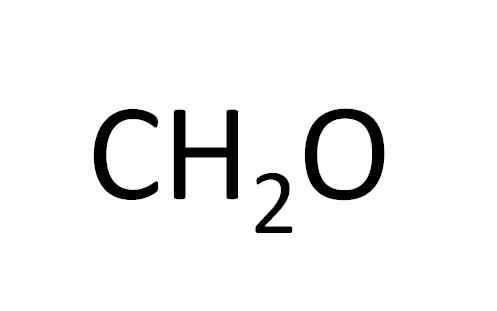
 Cette formule minimale révèle à peine que le composé a les mêmes quantités d'atomes de carbone et d'oxygène et d'atomes à double hydrogène. Source: Gabriel Bolívar.
Cette formule minimale révèle à peine que le composé a les mêmes quantités d'atomes de carbone et d'oxygène et d'atomes à double hydrogène. Source: Gabriel Bolívar. La formule minimale est également appelée formule empirique, car elle est obtenue à partir de l'expérimentation; c'est-à-dire qu'il est lié à l'expérience. Observation expérimentale a permis de conclure que deux atomes d'hydrogène sont combinés avec un atome d'hydrogène pour former de l'eau (H2SOIT).
Dans de nombreux cas, la formule minimale coïncide avec la formule moléculaire. Dans la moléculaire, le nombre réel des différents éléments qui forment un composé chimique apparaissent; C'est le cas, par exemple, de l'acide sulfurique (H2Swin4).
Mais dans d'autres cas, il n'y a pas de coïncidence de la formule minimale et de la formule moléculaire; Tel est le cas du benzène: la formule minimale est CH, tandis que sa formule moléculaire est C6H6.
[TOC]
Comment obtenir la formule minimale?
Premier pas
Trouvez les grammes de chaque élément présent dans le composé. Comme généralement exprimé en pourcentage de la masse du composé, un calcul simple doit être fait pour la transformation des pourcentages de masse de masse des éléments.
Deuxième pas
Le nombre relatif des atomes des différents éléments qui forment le composé chimique sont obtenus. Pour ce faire, la masse de chaque élément est divisée, exprimée en grammes, entre sa masse atomique.
Certains auteurs préfèrent appeler le nombre relatif d'atomes, comme le nombre de moles d'atomes des éléments qui font partie du composé chimique.
Peut vous servir: butanal: structure, propriétés, utilisations et risquesTroisième étape
Obtention de la proportion minimale, exprimée en nombre entières, de chacun des atomes présents dans le composé chimique.
Pour trouver ces valeurs, les nombres relatifs de chaque atome présent dans le composé entre la valeur numérique relative qu'un atome dans le composé chimique est divisé.
Dans le cas où la valeur de la proportion minimale d'un atome n'est pas un entier sans décimales, toutes les valeurs de la proportion minimale par un nombre doivent être multipliées; De cette façon, il permet à toutes les valeurs de la proportion minimale d'être des nombres entiers.
Par exemple, si la valeur de la proportion minimale d'un atome du composé chimique est 2.5, doit être multiplié tous Les valeurs de la proportion minimale de chacun des atomes présents par 2. Ainsi, toutes les valeurs de la proportion minimale ne seront que des nombres entiers.
Quatrième étape
Écrivez la formule composée minimale. Les valeurs de la proportion minimale pour les atomes des différents éléments seront placées comme indices des symboles chimiques des éléments pour écrire la formule minimale.
Exemples de formule minimale
Eau et dioxyde de carbone
La plupart des composés chimiques ont des formules qui sont, en même temps, des formules minimales et moléculaires. Ainsi, la formule de l'eau (h2O) est une formule minimale; Mais c'est aussi une formule moléculaire. Il en va de même pour la formule de dioxyde de carbone (CO2).
Oxydes de base et acide
Les oxydes et les acides de base sont des composés chimiques qui ont des formules chimiques, sauf si les exceptions sont à la fois minimales et moléculaires. La même situation se produit avec des hydroxydes et des acides, à l'exception de certains acides carboxyliques.
Peut vous servir: acétonitrile (C2H3N)Acide acétique
Les acides carboxyliques qui ont un nombre de paires d'atomes de carbone dans leur composition sont séparément, une formule minimale et une formule moléculaire. L'acide acétique, par exemple, a une formule moléculaire (c2H4SOIT2)); Mais il présente également une formule minimale (CHO2SOIT).
Acide butyrique
L'acide butyrique a également une formule moléculaire (C4H8SOIT2) et une formule minimale (c2H4SOIT).
Éthylène glycol
D'autres composés organiques ont les deux types de formules chimiques; Tel est le cas de l'éthylène glycol, qui a une formule moléculaire (c2H6SOIT2) et une formule minimale (CHO3SOIT).
Benzène
Le benzène, un composé aromatique, a une formule moléculaire (c6H6) et une formule minimale (CH).
Glucose
Le glucose a une formule moléculaire (c6H12SOIT6) et une formule minimale (CHO2SOIT).
Exercices résolus
- Exercice 1
L'éthylène glycol est un composé utilisé comme antigel, a un poids moléculaire de 62,1 g / mol et une composition de pourcentage de masse suivante:
C: 38%,
H: 9,7%
O: 51,16%.
Premier pas
Exprimer les pourcentages de masse des éléments dans leurs masses en grammes. Pour ce faire, le poids moléculaire de l'éthylenglicol est considéré comme une référence. Si cela représente 62,1 grammes par mol, 38% de la même chose consiste en carbone. Et ainsi de suite avec les autres éléments:
Masse du carbone = 62,1 g · (38/100)
= 23,6 g
Masse d'hydrogène = 62,1 g · (9,7 / 100)
= 6 024 g
Masse d'oxygène = 62,1 g · (51,16 / 100)
= 31,77 g
Deuxième pas
Calculez le nombre relatif de chaque atome actuel (NRA) ou le nombre de moles de chaque atome. Pour ce faire, la masse de chaque élément chimique est divisée par sa masse atomique.
NRA (C) = 23,6 g / 12 g
= 1,97
Il peut être arrondi à 2.
NRA (H) = 6 024 g / 1 g
= 6 024
Il peut être arrondi à 6.
NRA (O) = 31,77 g / 16 g
= 1 985
Il peut être arrondi à 2.
Troisième étape
Calculez la proportion minimale du nombre total des éléments du composé (PMNE). Pour ce faire, chacune des valeurs des nombres relatifs atomiques (NRA) est divisé par la valeur la plus basse de ce. Dans ce cas, 2.
Il peut vous servir: acide propanePMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMne (o) = 2/2
= 1
Quatrième étape
Écrivez la formule minimale d'éthylène glycol:
Ch3SOIT
Comme on peut le voir, les valeurs obtenues à l'étape 3 sont les indices des éléments composés.
- Exercice 2
L'acide acétique a un poids moléculaire de 60 g / mol et une composition de pourcentage de masse suivante:
C: 40%
H: 6,67%
O: 53,33%
Obtenir la formule composée minimale.
Premier pas
Transformez les pourcentages de masse des éléments en leurs masses exprimées en grammes:
Masse de carbone = 60 g · (40/100)
= 24 g
Masse d'hydrogène = 60 g · (6,67 / 100)
= 4 g
Masse d'oxygène = 60 g · (53,33 / 100)
= 32 g
Deuxième pas
Calculez le nombre relatif des atomes (NRA) du composé. Pour ce faire, les masses des éléments sont divisées entre leurs masses atomiques:
NRA (C) = 24 g / 12 g
= 2
Nra (h) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Troisième étape
Obtenir la proportion minimale de nombre entier des éléments du composé (PMNE). Pour ce faire, les valeurs de la NRA des éléments sont divisées entre la valeur inférieure de la NRA qui présente un élément:
PMNE (C) = 2/2
= 1
PMne (h) = 4/2
= 2
PMne (o) = 2/2
= 1
Quatrième étape
Écrivez la formule minimale d'acide acétique:
Ch2SOIT
Les indices du composé sont les valeurs obtenues à partir de PMNE.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (27 août 2019). Formule empirique: définition et exemple. Récupéré de: Thoughtco.com
- Wikipédia. (2020). Formule empirique. Récupéré de: dans.Wikipédia.org
- CHIMISTER BOOLISTexts. (3 juillet 2019). Formules calculatrices empiriques pour les composés. Récupéré de: Chem.Bibliothèque.org
- Nicola McDougal. (2020). Formule empirique: définition, étapes et exemple. Étude. Récupéré de: étudier.com
- « Caractéristiques et exemples de réaction irréversibles
- Formule moléculaire comment le sortir, exemples et exercices »

