Caractéristiques et exemples de réaction exergonique

- 4498
- 667
- Anaïs Julien
Ongle réaction exergonique C'est celui qui se produit spontanément et qui, en général, s'accompagne d'une libération d'énergie, soit sous forme de chaleur, de lumière ou de son. Lorsque la chaleur est libérée, on dit que nous sommes confrontés à une réaction exothermique et exergonique.
C'est pourquoi les termes «exothermiques» et «exergoniques» sont confus, devenant à tort comme des synonymes. En effet, de nombreuses réactions exothermiques sont également exergoniques. Par conséquent, si un grand détachement de chaleur et de lumière est observé, comme l'origine d'un incendie, on peut supposer qu'il se compose d'une réaction exergonique.
 La combustion du bois est un exemple de réaction exothermique et en même temps exergonique. Source: pixnio.
La combustion du bois est un exemple de réaction exothermique et en même temps exergonique. Source: pixnio. Cependant, l'énergie libérée peut passer inaperçue et ne pas être si surprenante. Par exemple, un milieu liquide peut chauffer légèrement et pour toujours être une conséquence d'une réaction exergonique. Dans certaines réactions exergoniques qui passent trop lentement, l'augmentation la plus basse de température n'est même pas observée.
Le point central et caractéristique de ce type de réactions thermodynamiques est la diminution de l'énergie libre de Gibbs dans les produits par rapport aux réactifs, ce qui se traduit par la spontanéité.
[TOC]
Caractéristiques des réactions exergoniques
Diagramme général
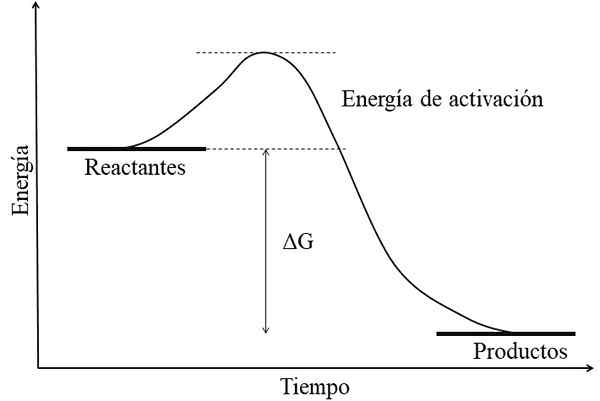 Diagramme d'énergie pour une réaction exergonique. Source: Gabriel Bolívar.
Diagramme d'énergie pour une réaction exergonique. Source: Gabriel Bolívar. La principale caractéristique d'une réaction exergonique est que les produits ont des énergies libres de GIBSS inférieures à celles des réactifs ou des réactifs (image supérieure). Ce fait est généralement associé aux produits est chimiquement plus stable, avec des liens plus forts, des structures plus dynamiques ou des conditions plus "confortables".
Par conséquent, cette différence d'énergie, ΔG, est négative (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Peut vous servir: système homogèneToutes ces variables qui répondent à la nature du phénomène ou à la réaction chimique considérée, permettent de déterminer si une réaction sera exergonique ou non. Et on verra également qu'il ne doit pas nécessairement être une réaction exothermique.
Lorsque l'énergie d'activation est très élevée, les réactifs nécessitent l'aide d'un catalyseur pour réduire ladite barrière d'énergie. C'est pourquoi il y a des réactions exergoniques qui sont données à des vitesses très basse, ou qui ne se produisent pas du tout en premier lieu.
Diminution d'énergie libre du système
L'expression mathématique suivante englobe ce qui est commenté ci-dessus:
ΔG = ΔH - TΔS
Le terme ΔH est positif s'il s'agit d'une réaction endothermique et négative si elle est exothermique. Si nous voulons que ΔG soit négatif, le terme TΔS doit être très grand et positif, de sorte que lors de la soustraction de ΔH, le résultat de l'opération est également négatif.
Par conséquent, et c'est une autre caractéristique particulière des réactions exergoniques: elles impliquent un grand changement dans l'entropie du système.
Ainsi, en tenant compte de tous les termes, nous pouvons être présents avant une réaction exergonique mais en même temps endothermique; c'est-à-dire avec ΔH positif, une température très élevée ou un changement de grande entropie.
La plupart des réactions exergoniques sont également exothermiques, car si ΔH est négative, et en soustrayant un autre terme encore plus négatif, nous aurons par conséquent un ΔG avec une valeur négative; À moins que TΔS ne soit négatif (l'entropie descend), et donc la réaction exothermique deviendrait endogonique (pas spontanée).
Il est important de souligner que la spontanéité d'une réaction (qu'elles soient exergoniques ou non) dépend grandement des conditions thermodynamiques; Tandis que la vitesse à laquelle il passe, est due à des facteurs cinétiques.
Il peut vous servir: la matière vivante: concept, caractéristiques et exemplesSpontanéité d'une réaction exergonique
Ce qui a été dit est connu depuis qu'une réaction exergonique est spontanée, si exothermique. Par exemple, un composé peut se dissoudre dans l'eau le refroidissant avec son récipient. Ce processus de dissolution est endothermique, mais quand il se produit spontanément, il est dit qu'il est exergonique.
Réaction exothermique
Il y a des réactions "plus exergoniques" que d'autres. Pour le savoir, l'expression suivante doit être à portée de main:
ΔG = ΔH - TΔS
Les réactions les plus exergoniques sont celles qui sont spontanément données à toutes les températures. C'est-à-dire, quelle que soit la valeur de T dans l'expression précédente, ΔH est négatif et ΔS positif (ΔH 0). Ce sont donc des réactions très exothermiques, qui ne contredisent pas l'idée initiale.
Il peut également y avoir des réactions exothermiques où l'entropie du système diminue (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Réaction endothermique
D'un autre côté, il y a des réactions qui ne sont spontanées qu'à des températures élevées: lorsque ΔH est positif et ΔS positif (ΔH> 0 et ΔS> 0). Nous parlons de réactions endothermiques. C'est pourquoi les descente de température peuvent se produire spontanément, car ils portent une augmentation de l'entropie.
En attendant, il y a des réactions qui ne sont pas du tout exergoniques: lorsque ΔH et ΔS ont des valeurs positives. Dans ce cas, quelle que soit la température, la réaction ne se produira jamais spontanément. Nous parlons alors, d'une réaction endary spontanée finale.
Peut vous servir: phase de dispersionExemples de réactions exergoniques
La chimie est généralement caractérisée par le fait d'être explosif et brillant, il est donc supposé que la plupart des réactions sont exothermiques et exergiques.
Combustions
Les réactions exergoniques sont les combustions des alcanes, des oléfines, des hydrocarbures aromatiques, des sucres, etc.
Oxidax métalliques
De même, les oxydations des métaux sont exergoniques, bien qu'elles passent plus lentement.
Réactions cataboliques de l'organisme
Cependant, il existe d'autres processus plus subtils, qui sont également exergoniques et très importants: les réactions cataboliques de notre métabolisme. Ici, les macromolécules décomposent qui agissent comme des réservoirs d'énergie, se libérant dans la chaleur et l'ATP, et grâce à laquelle le corps remplit bon nombre de ses fonctions.
La plus emblématique de ces réactions est la respiration cellulaire, en face de la photosynthèse, où les glucides avec de l'oxygène sont "brûlés" pour les transformer en petites molécules (CO2 et h2O) et énergie.
Autres
Parmi d'autres réactions exergoniques, nous avons la décomposition explosive du triaoduro d'azote, ou3; l'ajout de métaux alcalins d'eau, suivis d'une explosion; Synthèse polymère des résines éthoxylées; neutralisations acides en base dans une solution aqueuse; et réactions chimioscentes.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Walter J. Moore. (1963). Chimie physique. Dans la cinétique chimique. Quatrième édition, Longmans.
- L'Iran. Levine. (2009). Principes de la physicochimie. Sixième édition, page 479-540. Mc Graw Hill.
- Wikipédia. (2020). Réaction exergonique. Récupéré de: dans.Wikipédia.org
- Helmestine, Anne Marie, Ph.D. (16 septembre 2019). Endergonique vs réaction et processus exergoniques. Récupéré de: Thoughtco.com
- Réaction exergonique: définition et exemple. (18 septembre 2015). Récupéré de: étudier.com
- Académie Khan. (2018). Énergie gratuite. Récupéré de: est.Khanacademy.org
- « Formules d'énergie mécanique, concept, types, exemples, exercices
- Consommation durable pour ce qui est l'utilisation, l'importance, les actions, les exemples »

