Types de kératine, structure, emplacement et fonctions
- 2583
- 746
- Raphaël Meyer
La kératine Il s'agit d'une protéine fibreuse insoluble qui fait partie des cellules et des membres de nombreux organismes, en particulier des animaux vertébrés. Il a des formes très variées et est peu réactif, chimiquement parlant.
Sa structure a été décrite pour la première fois par les scientifiques Linus Pauling et Robert Corey en 1951, tout en analysant la structure des cheveux animaux. Ces chercheurs ont également donné des indications sur la structure de la myosine du tissu musculaire
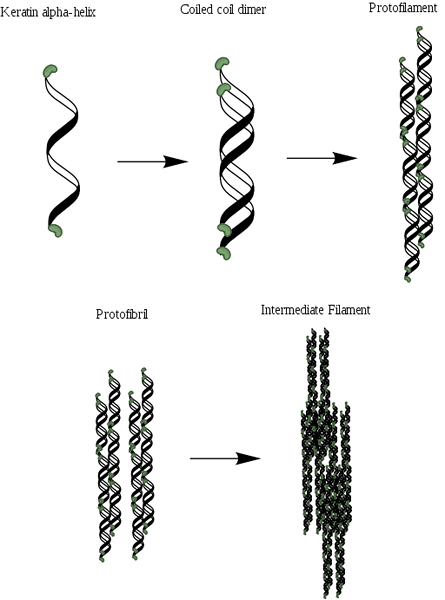
 Schéma d'organisation Alfa-Quératine (Source: Mlpatton [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Schéma d'organisation Alfa-Quératine (Source: Mlpatton [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Après le collagène, c'est l'une des protéines les plus importantes des animaux et représente la majeure partie du poids sec des cheveux, de la laine, des ongles, des griffes et des sabots, des plumes, des cornes et une partie substantielle de la couche externe de la peau.
Les éléments "kératinisés" des animaux peuvent avoir des morphologies très différentes qui dépendent, dans une large mesure, de la fonction qu'ils exercent dans chaque organisme particulier.
La kératine est une protéine qui a des caractéristiques qui lui donnent une grande efficacité mécanique en termes de tension et de compression. Il est produit par un type spécial de cellules appelées «kératinocytes», qui meurent généralement après leur produire.
Certains auteurs affirment que les kératines sont exprimées dans un tissu et un stade de scène. Chez l'homme, il y a plus de 30 gènes codants pour ces protéines et ceux-ci appartiennent à une famille qui a évolué pour plusieurs cycles de duplication génétique.
[TOC]
Types de kératines et leur structure
Il existe, essentiellement, deux types de kératines: α et β. Ceux-ci se distinguent par la possession d'une structure de base qui est principalement composée de chaînes polypeptidiques qui peuvent être inscrites sous forme d'hélices alpha (α-queatine) ou se joindre au parallèle comme les feuilles pliées β (β-cheap)).
α-questionnas
Ce type de kératine est le plus étudié et il est connu que les mammifères ont au moins 30 variantes différentes de ce type de kératine. Chez ces animaux, α-qui font partie des ongles, des cheveux, des cornes, des casques, des pointes et des épidermis.
Comme le collagène, ces protéines contiennent dans leur structure une proportion abondante de petits acides aminés tels que la glycine et l'alanine, qui sont ceux qui rendent possible la création d'hélices alpha. La structure moléculaire d'une α-quératine se compose de trois régions différentes: (1) des fibrilles ou propulseurs cristallins, (2) les domaines terminaux des filaments et (3) la matrice.
Les hélices sont deux et forment un dimère qui ressemble à une spirale enroulée qui reste unie grâce à la présence de liens ou de ponts disulfur (S-S). Chacune des hélices en a environ 3.6 déchets d'acides aminés à chaque tour qui donne et se compose de plus ou moins 310 acides aminés.
Il peut vous servir: flore et faune de la Sierra équatorienne: espèces représentativesCes spirales enroulées peuvent ensuite être associées pour former une structure connue sous le nom de protofilament ou de protofibrilla, qui a la capacité de s'assembler avec d'autres du même type.
Les protofilaments ont des extrémités non hélicoïdales N et C-terminales qui sont riches en résidus de cystéine et qui sont attachées à la région centrale ou à la matrice. Ces molécules se polymérisent pour former les filaments intermédiaires qui ont un diamètre près de 7 nm.
Deux types de filaments intermédiaires composés de kératine sont distingués: les filaments acides intermédiaires (type I) et les bases (type II). Ceux-ci sont intégrés dans une matrice de protéines et la façon dont ces filaments sont ordonnés influencent directement les propriétés mécaniques de la structure qui composent.
Dans les filaments de type I, les hélices se connectent entre elles au moyen de trois «connecteurs hélicoïdaux» connus sous le nom de L1, L12 et L2 et qui offrent une flexibilité au domaine hélicoïdal. Dans les filaments de type II, il existe également deux sous-domaines qui font partie des domaines hélicoïdaux.
Exemple d'une structure avec α-queatine: cheveux
Si la structure d'un cheveux typiques est analysée, elle a un diamètre approximatif de 20 microns et est composé de cellules mortes.
 Les cheveux de mammifères, comme cette vache, sont composés de kératine (source: Frank Winkler via Pixabay.com)
Les cheveux de mammifères, comme cette vache, sont composés de kératine (source: Frank Winkler via Pixabay.com) Les macropibrilles sont composées de microfibrilles, qui ont moins de diamètre et sont jointes les unes avec les autres à travers une substance protéique amorphe avec une teneur élevée en soufre.
Ces microfibrilles sont des groupes de protofibrilles plus petites avec un modèle d'organisation 9 + 2, ce qui signifie que neuf protofibrillas entourent deux protofibrilles centrales; Toutes ces structures sont essentiellement composées de α-quératine.
Kératines douces et kératines dures
Selon la teneur en soufre qu'ils ont, les α-questionnas peuvent être classées comme des kératines douces ou des kératines dures. Cela a à voir avec la force de résistance mécanique imposée par les liaisons disulfure dans la structure des protéines.
Dans le groupe de kératines dures, celles qui font partie des cheveux, des cornes et des ongles sont incluses, tandis que les kératines mous sont représentées par les filaments trouvés dans la peau et les callosités.
Les liaisons disulfure peuvent être éliminées en appliquant un agent réducteur, de sorte que les structures composées de kératine ne sont pas facilement digestibles par les animaux, sauf si elles ont des intestins riches en marchandises, comme c'est le cas avec certains insectes.
Il peut vous servir: ficologieβ-questionnas
Β-qui sont beaucoup plus forts que les α-quératines et se trouvent dans les reptiles et les oiseaux dans le cadre des griffes, échelles, plumes et pics. Dans les geckos, les microvages trouvés dans leurs jambes (champignons) sont également composés de cette protéine.
Sa structure moléculaire est constituée de feuilles à pelures β formées par des chaînes polypeptidiques antiparalletes qui se lient ensemble par des liaisons ou des ponts d'hydrogène. Ces chaînes, côte à côte, forment de petites surfaces rigides et plates, légèrement pliées.
Où êtes-vous et quelles sont vos fonctions?
Les fonctions de kératine sont liées, surtout, au type de structure qu'il construit et à la place du corps de l'animal où il est situé.
Comme d'autres protéines fibreuses, cela confère la stabilité et la rigidité structurelle aux cellules, car elle appartient à la grande famille de protéines connues sous le nom de famille des filaments intermédiaires, qui sont des protéines du cytosquelette.
En protection et en couverture
La couche supérieure de la peau des animaux supérieurs a un grand réseau de filaments intermédiaires formés de kératine. Cette couche est appelée épiderme et a entre 30 microns et 1 nm d'épaisseur chez l'homme.
L'épiderme fonctionne comme une barrière protectrice contre différents types de stress mécanique et chimique et est synthétisé par un type spécial de cellules appelées "kératinocytes".
En plus de l'épiderme, il y a une couche encore plus externe qui se déplace constamment.
Les espinas et les púas sont également utilisés par divers animaux pour leur propre protection contre les prédateurs et autres agresseurs.
L '"armure" des pangolines, certains petits mammifères insectivores qui habitent l'Asie et l'Afrique, est également composé de "balances" de kératine qui les protègent.
Dans la défense et d'autres fonctions
Les cornes sont observées chez les animaux de la famille Bovidae, c'est-à-dire chez les vaches, les moutons et les chèvres. Ce sont des structures très fortes et résistantes et les animaux qui les font utiliser comme organes de défense et de parade nuptiale.
Les cornes sont formées par un centre d'os composé d'os "spongieux" couvert par une peau qui est projetée à partir de la zone postérieure du crâne.
 Les ongles sont un autre exemple de parties du corps composées de kératine (source: Adobe Stock via Pixabay.com)
Les ongles sont un autre exemple de parties du corps composées de kératine (source: Adobe Stock via Pixabay.com) Les griffes et les ongles, en plus de leurs fonctions dans la nourriture et le soutien, servent également des animaux comme une défense des "armes" contre les attaquants et les prédateurs.
Peut vous servir: Théorie des fixistes: concept, postulates et auteursBird Peaks remplit plusieurs fins, parmi lesquelles la nourriture, la défense, la parade nuptiale, l'échange de chaleur et les toilettes, entre autres, entre autres. Plusieurs variétés de picos chez les oiseaux se trouvent dans la nature, en particulier en termes de forme, de couleur, de taille et de force des mâchoires associées.
Les pics sont composés, tout comme les cornes, par un centre osseux qui est projeté à partir du crâne et est recouvert de feuilles de β-quératine résistantes.
Les dents des animaux non pelées (vertébrés «ancestraux») sont composées de kératine et, comme les dents des vertébrés «supérieurs», ont de multiples fonctions dans la nourriture et la défense.
Dans le mouvement
Les casques de nombreux ruminants et animaux uulés (chevaux, ânes, allces, etc.) Ils sont composés de kératine, ils sont très résistants et conçus pour protéger les jambes et collaborer au mouvement.
Les plumes, qui sont également utilisées par les oiseaux pour se déplacer, sont composées de β-cheap. Ces structures, en outre, ont des fonctions de camouflage, de parade nuptiale, d'isolation thermique et d'impermerabilité.
 Les plumes et le pic des oiseaux sont également composés de kératine (source: Couleur, via Pixabay.com)
Les plumes et le pic des oiseaux sont également composés de kératine (source: Couleur, via Pixabay.com) Dans l'industrie
L'industrie textile est l'un des principaux exploiteurs des structures kératinisées, anthropocentriquement parlant. La laine et les cheveux de nombreux animaux sont importants au niveau industriel, car avec eux, divers vêtements utiles aux hommes de divers points de vue sont fabriqués.
Les références
- Koolman, J., & Roehm, k. (2005). Atlas de la couleur de la biochimie (2e éd.). New York, États-Unis: Thieme.
- Mathews, C., Van Holde, K., & Ahern, k. (2000). Biochimie (3e érigé.). San Francisco, Californie: Pearson.
- Nelson, D. L., & Cox, M. M. (2009). Principes de lehninger de la biochimie. Éditions Omega (5e Ed.).
- Pauling, L., & Corey, R. (1951). La structure des cheveux, des muscles et des protéines apparentées. Chimie, 37, 261-271.
- Phillips, D., Korge, b., & James, W. (1994). Kératine et kératinisation. Journal de l'American Academy of Dermatology, 30(1), 85-102.
- Rouse, J. g., & Dyke, m. ET. Aller. (2010). Une revue des biomatériaux à base de kératine pour les applications biomédicales. Matériaux, 3, 999-1014.
- Smith, F. J. D. (2003). La génétique moléculaire des troubles de la kératine. Am J Clin Dermatol, 4(5), 347-364.
- Voet, D., & Voet, J. (2006). Biochimie (3e érigé.). Pan -American Medical Editorial.
- Wang, B., Yang, w., McKitrick, J., & Meyers, m. POUR. (2016). Kératine: Structure, propriétés mécaniques, occurrence dans les organismes biologiques et efforts en matière de bioinspiration. Progrès dans la science matérielle.
- « Nouvelle-Espagne et relations avec les antécédents mondiaux, routes
- Caractéristiques d'apprentissage de la répétition, avantages, inconvénients »

