Fondation de test de catalase, technique et utilisations

- 2697
- 589
- Raphaël Charles
La catalase Il s'agit d'une méthodologie utilisée dans les laboratoires de bactériologie pour mettre en évidence la présence d'enzyme catalase dans les bactéries qui le possèdent. À côté de la coloration de Gram se trouvent les principaux tests qui doivent être effectués sur des micro-organismes fraîchement isolés. Ces tests guident le microbiologiste sur les étapes à suivre pour l'identification définitive du micro-organisme en question.
En général, les bactéries contenant du cytochrome ont l'enzyme catlase, c'est-à-dire que les bactéries anaérobies aérobies et facultatives devraient le posséder. Cependant, il existe des exceptions, comme Streptococcus, qui, bien qu'il soit facultatif, les micro-organismes anaérobies ne possèdent pas l'enzyme catalase.
 Exécution du test de catalase, montrant une réaction positive. Source: Aucun auteur lisible par machine fourni. Nase supposé (sur la base des réclamations du droit d'auteur). [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]
Exécution du test de catalase, montrant une réaction positive. Source: Aucun auteur lisible par machine fourni. Nase supposé (sur la base des réclamations du droit d'auteur). [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]] C'est pourquoi le test de catalase est principalement utilisé pour distinguer Staphylococaee et Micrococaceae (tous deux catalase positive) de la famille Streptococae (catalase négative) (catalase négative).
De même, le genre Bacillus (catalase positive) se distingue du genre Clostridium (catalase négative), entre autres.
[TOC]
Base
La catalase est une enzyme classifiée comme hydroperoxydase, cela signifie qu'ils utilisent du peroxyde d'hydrogène comme substrat (H2SOIT2).
Il est également considéré comme une oxydoréductase, car dans la réaction où il y a un élément qui sert de donneur d'électrons (réduction de substance) et un autre comme récepteur d'électrons (substance oxydante).
La catalase est une protéine qui contient un groupe prostorique avec quatre atomes de fer trivalents (foi+++), c'est donc une homoprotéine. L'ion ferrique reste oxydé pendant la réaction.
On peut dire que la catalase est une enzyme détoxifiante, car sa fonction consiste à éliminer les substances qui se produisent pendant le métabolisme bactérien qui sont toxiques pour les bactéries. Parmi ces substances est le peroxyde d'hydrogène.
Le peroxyde d'hydrogène est formé à partir de la décomposition des sucres par l'aérobic. Ce processus se produit comme suit:
L'ion superoxyde (ou2-) (Radical libre) est formé comme un produit final de l'assimilation du glucose par la route aérobie. Ceci est toxique et est éliminé par l'enzyme de superoxyde de dysmutase qui le transforme en oxygène gazeux et peroxyde d'hydrogène.
Il peut vous servir: Holdridge Life Zones: ce qui est en Amérique latineLe peroxyde d'hydrogène est également toxique pour les bactéries et doit être éliminé. L'enzyme de catalase se déploie du peroxyde d'hydrogène dans l'eau et l'oxygène.
La catalase peut agir sur d'autres substrats autres que le peroxyde d'hydrogène, comme les alcools, les aldéhydes, les acides, les amines aromatiques et les phénols. Cependant, le peroxyde d'hydrogène peut également être utilisé par la catalase pour oxyder d'autres composés toxiques tels que l'alcool méthylique et éthylique.
De même, la catalase est présente dans les cellules phagocytaires, la protégeant de l'action toxique du peroxyde d'hydrogène.
Technique de routine pour le test de catalase
-Méthode dans la diapositive
Matériaux
3% de peroxyde d'hydrogène (10 volumes).
Lame portable
Poignée en plastique jetable ou bâton en bois.
Procédure
Prendre suffisamment de montant de la colonie pour étudier sans toucher l'agar à partir de laquelle il provient. La colonie doit être fraîche, c'est-à-dire d'une récolte de 18 à 24 heures.
Placer la colonie sur le support sec et ajouter une goutte de peroxyde d'hydrogène à 3% (vous pouvez également utiliser H2SOIT2 à 30%). Observer immédiatement si les bulles sont détachées ou non.
Interprétation
Réaction positive: détachement de gaz, qui est évident avec la formation de bulles (bulle forte).
Réaction négative: il n'y a pas de formation de bulles.
-Méthode directe en culture pure
Place 1 ml de h2SOIT2 3% sur les cultures pures dans les assiettes ou les quartiers qui ne contiennent pas de sang (de préférence nutritif). Observez s'il y a ou non la formation de bulles immédiatement. Vous pouvez également utiliser H2SOIT2 30%.
Il est interprété comme la méthode du support d'objet.
-Méthode avec capillaire ou fung et tube de Petrishko
Remplissez un tube capillaire de 67 mm à une hauteur de 20 mm avec un peroxyde d'hydrogène à 3% par capillarité.
Touchez la colonie isolée que vous souhaitez étudier avec le capillaire plein de H2SOIT2 3%. Observez si le capillaire est rempli de bulles en environ 10 secondes. Cette méthode permet de semi-quantifier la réaction aux croix:
Sans croix, il n'y a pas de bulles (réaction négative).
Peut vous servir: flore et faune des îles Falkland: espèces exceptionnelles+ --Bulles rares (réaction faible ou retardée).
++ -Bulles abondantes (réaction modérée).
+++ -Les bulles atteignent l'extrémité opposée (réaction énergique).
-Méthode Taylor et Achanzar pour les tests de catalase qui donnent douteux
Dans une diapositive propre et sèche, placa une colonie isolée, puis placez une goutte de H2SOIT2 0,5% et couverture avec des couvertures. Observez s'il existe ou non une formation de bulles emprisonnées.
Interprétation: La présence de bulles indique une réaction positive. Sans bulles, il est interprété comme une réaction négative.
Test de catalase pour les espèces de Mycobacterium
Cette technique doit être effectuée en contrôlant le pH et la température. Il doit être exécuté sous une cloche d'écoulement laminaire, car la manipulation des différentes espèces de Mycobacterium est dangereuse.
-Matériaux
Peroxyde d'hydrogène à 30% ou 110 volumes (Superoxal).
Tampon de phosphate pH 7
Tween 80 à 10%
Culture Mycobacterium en coin de 3 à 4 semaines
-préparation de réactifs
Tampon de phosphate pH 7
Peser:
1 361 g de (kh2Pote4) Anhydra.
1 420 g de (Na2HPO3) phosphate dysodique anhydre.
Dissoudre les deux sels dans un peu d'eau distillée stérile et avec de l'eau jusqu'à 1000 ml.
Tween 80 à 10%
Effectuer une dilution 1:10 à la Tween 80 qui est concentrée commercialement, pour que cela se déroule comme suit:
Prenez 1 ml de Tween 80 et placez-le dans un peu d'eau distillée, dissolvez puis complétez le volume avec de l'eau jusqu'à 10 ml.
Réactif final
Mélanger une quantité de tampon de phosphate avec une quantité de tween 80 à 10% (en parties égales). Définissez en laboratoire combien vous voulez préparer.
-Procédure
Placer 5 ml de tampon de phosphate dans un tube à essai stérile avec un couvercle file (baquelita).
Avec une poignée d'inoculation, prenez suffisamment de colonie d'une croissance de Mycobacterium semé dans des coins et dissolvez dans le tampon phosphate.
Couvrir le tube sans serrer le fil. Placer dans une salle de bain à 68 ° C pendant 20 à 30 minutes. Sortez et refroidissez à 22-25 ° C
Mesurez 0,5 ml du réactif final (mélange) et ajoutez-le au tube avec la solution froide. Observer ou non la formation de bulles.
Il est interprété ainsi que les techniques précédentes.
Utiliser
Lorsqu'une croissance des colonies dans des milieux enrichies est obtenue, une coloration gram et un test de catalase doivent être effectuées aux colonies obtenues. Cela guidera le microbiologiste sur les procédures à suivre pour une identification définitive.
Peut vous servir: épithélium plat simple: caractéristiques, fonctions et types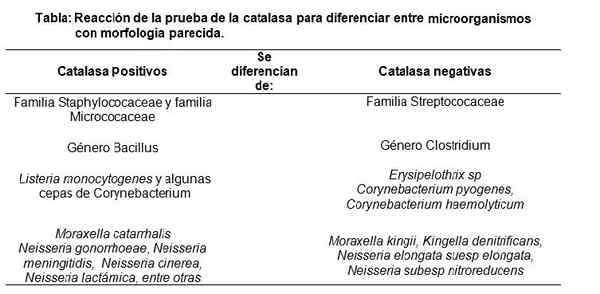 Source: Préparé par l'auteur MSC. Marielsa Gil
Source: Préparé par l'auteur MSC. Marielsa Gil Contrôle de qualité
Pour évaluer le bon fonctionnement du réactif de peroxyde d'hydrogène, utilisez des contrôles fraîchement cultivés, tels que Staphylococcus aureus comme contrôle positif et souches de Streptococcus sp comme contrôle négatif.
Une autre alternative qui sert de contrôle positif est de placer une goutte de peroxyde d'hydrogène sur l'agar sanguine, les érythrocytes ont une catalase, par conséquent, il y aura un bouillonnement si le réactif est en bon état.
Vous pouvez utiliser une gélose au chocolat comme contrôle négatif, ici les érythrocytes sont déjà répertoriés et le test donne négatif.
Limites
-N'utilisez pas de vieilles cultures pour le test, car cela peut provoquer de faux négatifs.
-Évitez de prendre des colonies des cultures dans l'agar sanguine, si vous faites attention à ne pas toucher l'agar; Cette procédure peut provoquer de faux positifs, car les érythrocytes contiennent une catalase.
-Si vous prenez la colonie avec une poignée Platinum, n'investissez pas l'ordre de la procédure car cela peut générer de faux positifs. En effet.
-N'utilisez pas le réactif de peroxyde d'hydrogène s'il est très ancien, car le réactif est très instable et a tendance à se décomposer avec le temps.
-Gardez le réactif du peroxyde d'hydrogène protégé de la lumière et de la réfrigération pour éviter les dommages.
-Effectuer un contrôle de qualité au réactif du peroxyde d'hydrogène à chaque fois qu'il est utilisé.
-Tenez compte que si H est utilisé2SOIT2 À 30%, les réactions sont plus fortes que celles effectuées avec H2SOIT2 3%.
Les références
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e ed. Pan -American Editorial S.POUR. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique de Bailey & Scott. 12 ed. Pan -American Editorial S.POUR. Argentine.
- Mac Faddin J. (2003). Tests biochimiques pour l'identification des bactéries d'importance clinique. 3e édition. Éditorial Pan-American. Buenos Aires. Argentine.
- Laboratoires BD. Réactif catalase. Disponible sur: http: // winklerltda.CL
- Laboratoires Vadequímica. Eau oxygénée. Équivalence entre les volumes et le pourcentage. Disponible sur: VADEQUIMICA.com
- « Événements complémentaires ce qu'ils sont composés et des exemples
- Biographie, style et œuvres de Josep Carner »

