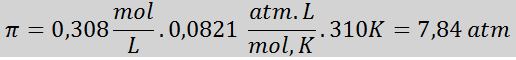Propriétés coligatives des solutions
- 3412
- 808
- Jade Duval
Que sont les propriétés coligatives?
Le Propriétés colligatives, Également appelées propriétés collectives des solutions, ce sont un groupe de quatre propriétés qui dépendent uniquement de la quantité de particules présentes dans la solution, mais pas de la nature de ces particules.
En d'autres termes, ces propriétés découlent de la présence de particules autres que le solvant, c'est-à-dire des particules du soluté, mais ne dépendent pas de qui est le soluté. Tout type de particule peut donner naissance à des propriétés coligatives, peu importe si ce sont des atomes, des ions ou des molécules. La seule chose qui compte, c'est votre concentration.
Les propriétés coligatives sont de quatre:
- Décision de la pression de vapeur du solvant
- Élévation ebulllloscopique
- Descente crioscopique
- Pression osmotique
Tous se caractérisent par la proportion de la concentration du soluté dans le cas de solutions relativement diluées (concentration <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Voyons en détail chacune de ces quatre propriétés:
1. Décision de la pression de vapeur du solvant
Lorsqu'une solution de soluté non volatile est préparée, la pression de vapeur de la solution résultante est toujours inférieure à la pression de vapeur du solvant pur. En d'autres termes, dissoudre un soluté non volatile dans un solvant, provoque une diminution de la pression de vapeur dudit solvant, par rapport au solvant pur.
Formule de la pression de la vapeur diminuer
Comme toutes les propriétés coligatives, la diminution de la pression de vapeur (DP) est proportionnelle à la concentration du soluté. En combinant la loi de Raault avec les équations de fraction molaire, il peut être démontré que DP est donné par:
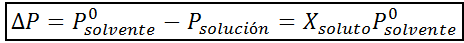
où p °solvant représente la pression de vapeur du solvant pur à une certaine température, psolution correspond à la pression de vapeur de la solution et xsoluté représente la concentration du soluté exprimé en fraction molaire.
Pourquoi diminue la pression de vapeur avec le soluté?
La force qui entraîne la plupart des processus naturels, comme l'évaporation d'un solvant, est l'augmentation de l'entropie ou du niveau de désordre. Lorsqu'un liquide s'évapore, il passe d'un état très ordonné (dans le liquide) à un très désordonné (en gaz), car dans la phase gazeuse, il y a beaucoup plus de liberté de mouvement.
Peut vous servir: verre violetCependant, dans une solution, la présence du soluté ajoute un trouble à la phase liquide sans affecter la phase gazeuse (puisque le soluté n'évapore pas).
Pour cette raison, la différence de niveau de trouble entre la solution et la phase gazeuse est inférieure à celle du solvant pur et de la phase gazeuse, donc le solvant a moins tendance à s'évaporer dans le deuxième cas.
Exemple
Problème: Sachant que la pression de vapeur d'eau à une certaine température est de 30,55 mmHg, déterminez la pression de vapeur d'une solution préparée dissolvant 7,20 grammes de glucose (masse molaire ou mm = 180 g / mol) dans 360 g d'eau (mm = 18,0 g / mol) à la même température.
Solution: Dans ce cas, la fraction molaire du soluté doit être calculée en premier. Nous avons déjà toutes les données nécessaires à ce sujet:
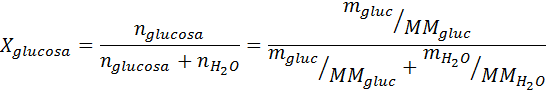
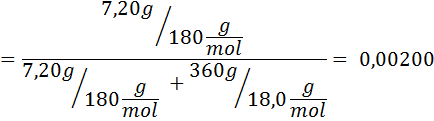
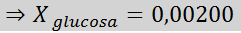
Ensuite, l'équation de la diminution de la pression de vapeur est appliquée.
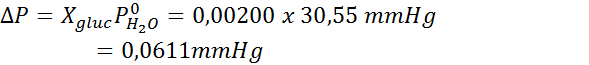
Maintenant, nous déterminons la nouvelle pression de vapeur du solvant:
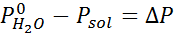
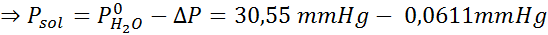
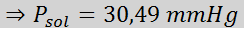
2. Élévation ebullloscopique ou point d'ébullition
L'élévation ebulllloscopique fait référence à l'augmentation du point d'ébullition d'une solution par rapport au point d'ébullition du solvant pur. Pour comprendre pourquoi cela se produit, n'oubliez pas que le point d'ébullition est défini comme la température à laquelle la pression de vapeur d'un liquide est effectuée égale à la pression atmosphérique.
Comme les solutions ont une pression de vapeur plus petite que le solvant pur (comme nous venons de le voir dans la section précédente), il est nécessaire de le chauffer davantage pour pouvoir atteindre la pression atmosphérique et ainsi atteindre son point d'ébullition. Pour cette raison, le point d'ébullition des solutions (avec des solutés non volatiles) est toujours supérieur à celui du solvant pur.
Formule d'élévation ebulllloscopique
L'augmentation du point d'ébullition (DTb) Il est proportionnel à la concentration du soluté exprimé en molélité, comme indiqué par l'équation suivante:
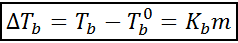
Où tb C'est le point d'ébullition de la solution, tb° c'est le point d'ébullition du solvant pur, kb C'est la constante ebullloscopique du solvant et m C'est la molélité du soluté.
Exemple
Problème: Sachant que la constante d'ébullition de l'eau est de 0,52 ° C.kg / mol, déterminer le point d'ébullition de la solution de glucose préparée dans l'exemple précédent.
Solution: Pour déterminer l'élévation ebullloscopique, nous n'avons besoin que de la moralité.
Peut vous servir: Oxyde d'étain (II): structure, propriétés, nomenclature, utilisations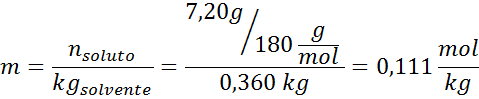
Maintenant, nous appliquons la formule DTb:
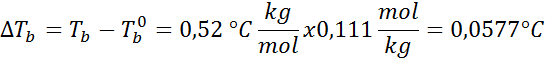
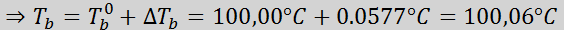
3. Descente crioscopique
La diminution cryoscopique est la diminution du point de congélation d'une solution par rapport au point de congélation du solvant pur. La raison pour laquelle cela se produit est similaire à l'augmentation ebullloscopique et a son origine dans la diminution de la pression de vapeur.
Cette propriété est largement utilisée par temps froid où elle neige en hiver. Dans ces pays, il est très courant de voir des camions répandre des sels comme NaCl ou CACL2 sur les routes ou sur les bancs publics, après quoi la neige fond. La raison pour laquelle il fond est que le sel diminue le point de congélation de l'eau.
Formule de descente crioscopique
L'équation de descente chrioscopique est très similaire à celle de l'augmentation ebullloscopique. Il est également proportionnel à la concentration morale et dépend, dans ce cas, d'une constante cryoscopique du solvant.
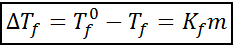
où tF C'est le point de congélation de la solution, tF° c'est le point de congélation du solvant pur, kF C'est la constante chrioscopique du solvant et m C'est la molélité du soluté.
Exemple
Problème: Sachant que la constante d'eau cryoscopique est de 1,86 ° C.kg / mol, déterminer le point de congélation de la solution de glucose préparée dans l'exemple précédent.
Solution: La moralité de la solution était déjà déterminée, nous pouvons donc déterminer directement DTF Utilisation de la formule précédente:
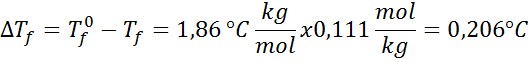
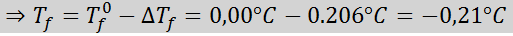
4. Pression osmotique
L'osmose est un processus d'une grande importance au niveau chimique et biologique. Il s'agit de l'écoulement des molécules de solvant (par exemple, de l'eau) d'une solution diluée à une autre solution plus concentrée lorsqu'ils sont séparés au moyen d'une membrane semi-perméable (qui ne permet que le solvant ne passer, mais pas le soluté).
Cette tendance à «absorber» le solvant à travers une membrane semi-perméable est une propriété qui dépend uniquement de la concentration totale de particules de soluté présentes dans la solution, quel que soit le soluté. Pour cette raison, cette tendance est une propriété coligative et est mesurée par pression osmotique.
La pression osmotique (π) est la pression qui doit être appliquée à une solution pour arrêter l'osmose. Plus la pression osmotique est élevée, plus la solution de la solution à absorber le solvant (ou, plus précisément, plus la tendance du solvant pour se propager vers cette solution) a la solution).
Peut vous servir: Magnésium: histoire, structure, propriétés, réactions, utilisationsPourquoi l'osmose se produit-elle?
L'explication derrière le processus d'osmose est très simple. Toutes les substances ont tendance à se propager à partir de l'endroit où ils sont plus concentrés où ils sont plus dilués. On dit de suivre votre gradient de concentration.
Lorsqu'une solution est plus concentrée en soluté, en même temps, elle est plus diluée en solvant et vice versa. Pour cette raison, le solvant a une tendance naturelle à passer de la solution la plus diluée (où le solvant est plus concentré) vers la solution la plus concentrée (où elle est plus diluée).
Formule de pression osmotique
La pression osmotique peut être calculée avec une formule très similaire à l'équation des gaz idéaux:
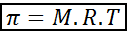
Dans cette équation, π est la pression osmotique, m est la concentration molaire du soluté, R est la constante universelle des gaz idéaux (0,0821 atm.L / mol.K) et t est la température absolue en k.
Pression osmotique et tonique
La pression osmotique est très importante pour le fonctionnement du corps humain. En fait, les solutions salines injectées par voie intraveineuse sont classées en fonction de la question de savoir si leur pression osmotique est plus élevée, égale ou inférieure à celle du plasma sanguin à ce qu'on appelle la tonique.
- Une solution moins concentrée que le plasma a une pression osmotique plus faible et est racontée Solution hypotonique.
- Si vous avez la même concentration totale de solutés, on dit solution isotonique.
- Si vous avez une plus grande pression osmotique (ou concentration), il est dit solution hypertonique.
Exemple
Problème: Calculez la pression osmotique à 310 K d'une solution saline à 0,9% (M / V), qui est isotonique avec du plasma sanguin.
Solution: Nous avons déjà la température, donc la seule chose qui manque est de déterminer la concentration molaire des particules de sel (NaCl) dans la solution. Pour ça.
Tous les 100 ml de solution contient 0,9 g de NaCl, donc:
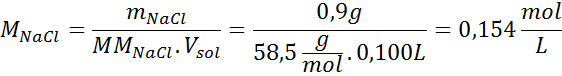
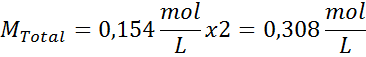
Il s'agit de la concentration totale de particules de soluté dans la solution, donc nous pouvons maintenant calculer la pression osmotique: