Forces intermoléculaires
- 818
- 235
- Prof Noah Collet
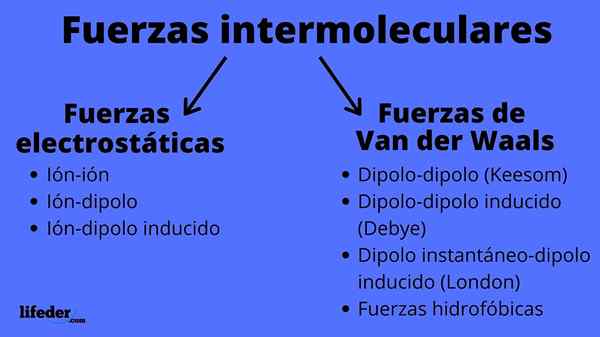
 Schéma des types de forces intermoléculaires
Schéma des types de forces intermoléculaires Quelles sont les forces intermoléculaires?
Le Forces intermoléculaires Ils sont un ensemble d'interactions qui se déroulent entre les molécules, que ce soit du même composé chimique ou non, et qui les maintient ensemble. Grâce à ces forces, les molécules parviennent à regrouper et à définir un solide, un liquide ou un gaz; c'est-à-dire qu'ils sont responsables des propriétés physiques des substances.
Les forces intermoléculaires peuvent être de deux types: électrostatique ou van der Waals. Les électrostatiques sont tous ceux où nous avons des ions, qui sont des atomes ou des molécules chargés électriquement (+ ou -). Pendant ce temps, ceux de van der Waals impliquent des atomes ou des molécules neutres qui, par les fluctuations de leur distribution électronique, sont polarisés et attirés ou repoussés les uns avec les autres.
Les forces intermoléculaires peuvent être comparées à l'union existante entre différents morceaux de laïc. Selon leurs formes et directives, leurs syndicats deviennent plus faibles ou plus faibles, tout comme ils changent la conception et les dimensions finales de la construction.
Plus ces forces sont fortes, plus il sera difficile de séparer les morceaux de laïc ou, dans le cas de la chimie, les molécules. Cela signifie également qu'il y aura un plus grand compactage et que, par conséquent, les molécules définiront des liquides plus visqueux, des gaz plus lourds ou plus denses.
Autres propriétés physiques telles que la fusion et les points d'ébullition, la volatilité, la texture, etc., Ce sont également des réflexes macroscopiques des forces intermoléculaires qui régissent entre les molécules ou les ions d'un composé ou des mélanges. Par exemple: les forces intermoléculaires des gaz sont très faibles par rapport à celles d'une pierre.
Comprendre les forces intermoléculaires est essentielle pour décrire de nombreux concepts chimiques, physiques et biologiques.
Forces électrostatiques
Ion-ion
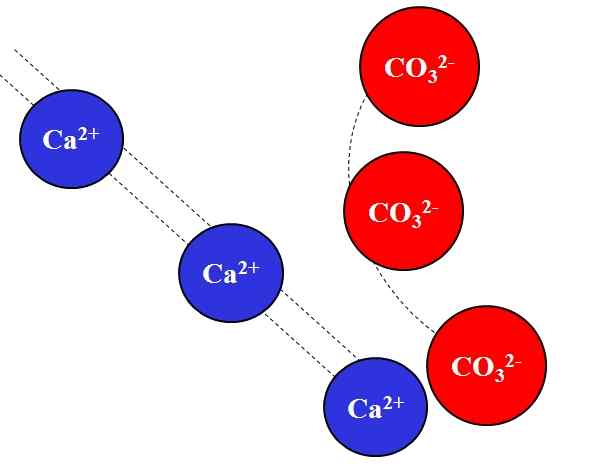 Attraction électrostatique entre les ions CA2 + et CO32-. Source: Gabriel Bolívar.
Attraction électrostatique entre les ions CA2 + et CO32-. Source: Gabriel Bolívar. Charges opposées que les ions attirent avec une grande force, qui est due à la loi de Coulomb, et diminue rapidement plus les ions s'éloignent.
Par exemple, le CA ion2+ C'est une charge positive, un cation, tandis que le CO32- C'est un ion de charge négatif, un anion. Être vos charges opposées, CA2+ et Cie32- Ils s'attirent, évitant que plus ils sont proches, plus ils resteront ensemble.
Au contraire, les ions avec la même charge, qu'ils soient positifs ou négatifs, repoussent avec la même force mais dans le sens opposé. Ainsi, le CA2+ Repoussant les ions comme Na+, Mg2+, K+, etc., À moins qu'il y ait d'autres anions qui diminuent la répulsion.
Il peut vous servir: Dibenzalacetona: propriétés, mécanisme de réaction, utilisations, risquesDe toutes les forces intermoléculaires, celles du type d'ion ion est la plus simple; Mais en même temps, le plus fort de tous. Beaucoup d'énergie ou de chaleur est nécessaire pour séparer les ions.
Ion-dipolo
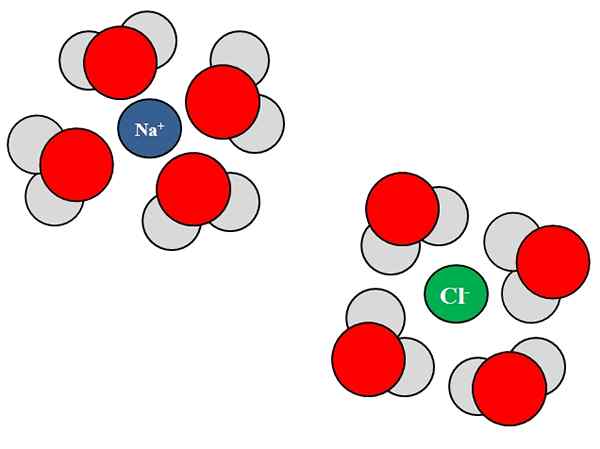 Interactions ion-dipolo entre les molécules d'eau et les ions NaCl. Source: Gabriel Bolívar.
Interactions ion-dipolo entre les molécules d'eau et les ions NaCl. Source: Gabriel Bolívar. Les ions peuvent également interagir avec des atomes ou des molécules neutres, comme l'eau. Cela est particulièrement vrai en ce qui concerne les molécules d'un solvant, que Solvata, c'est-à-dire entoure les ions dans leur liquide.
Par exemple, le chlorure de sodium, NaCl, se compose de na ions+ et cl-. Lorsque leurs cristaux sont jetés dans l'eau, les molécules d'eau, H2O ou hoh, hydrater ou entourer les ions de NaCl; Mais la façon dont ils le font varie en fonction de l'ion en question.
Ainsi, nous voyons dans l'image supérieure que l'ion na+ est hydraté par les atomes d'oxygène H H2SOIT. Pendant ce temps, l'ion cl- est hydraté par des atomes d'hydrogène.
Parce que? Parce que l'eau est une substance polaire, ce qui signifie qu'elle a un dipôle: un poteau avec une charge partielle positive et une autre avec une charge partielle négative.
L'atome d'oxygène, car il est plus électronégatif, attire les électrons vers eux-mêmes, localisant ainsi les électrons plus fréquemment autour de cet atome; quelque chose qui ne se produit pas de la même manière avec les atomes d'hydrogène, moins électronégatifs. L'oxygène, car il est plus négatif, est orienté vers NA+; Tandis que les hydrogènes, parce qu'ils sont plus positifs, sont orientés vers le CL-, Puisque les charges opposées sont attirées.
Ion-dipolo induit
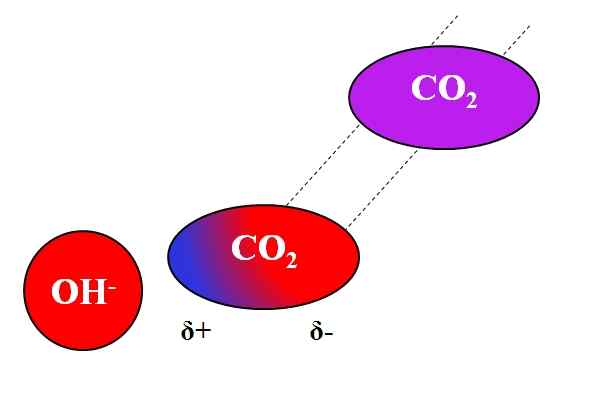 Action inductive oh- sur la molécule co₂. Source: Gabriel Bolívar.
Action inductive oh- sur la molécule co₂. Source: Gabriel Bolívar. Non seulement les molécules polaires ou dipoles peuvent interagir avec les ions. Pour les atomes ou molécules neutres, même s'ils n'ont pas de dipôles, la distribution de leurs électrons est sensible aux effets inductifs des ions voisins; c'est-à-dire que les ions provoquent une polarisation momentanée et brève, assez pour une interaction notable.
Peut vous servir: acétate de plomb: structure, propriétés, obtention, utilisationsSupposons par exemple l'interaction entre oh ion- et le CO2. Le CO2 C'est un composé neutre, dont la molécule (en violet) manque de dipôle. Cependant, comme oh approche-, La charge négative de ce repère aux électrons des atomes d'oxygène du CO2.
Plus OH est proche- et le CO2, Plus fort sera la répulsion. Par conséquent, un dipôle induit par l'OH commence à être établi- À propos de CO2. Un pôle positif apparaît Δ + parce que les électrons, repoussés, "émigrer" à l'autre extrémité de la molécule.
Ainsi, oh- et le CO2 Ils restent assez ensemble pour réagir les uns avec les autres. C'est la raison pour laquelle CO2 Il est particulièrement soluble dans les solutions alcalines.
Forces de van der Waals
Les forces de van der Waals, en principe, ne se réfèrent qu'à celles qui existent entre des atomes ou des molécules neutres, sans charges ioniques.
Dipolo-dipolo (keesom)
 Forces dipolo-dipolo. Source: Gabriel Bolívar.
Forces dipolo-dipolo. Source: Gabriel Bolívar. Les charges opposées sont attirées, les charges égales repoussent. Il en va de même pour les dipôles: les pôles opposés (Δ + et Δ-) sont attirés, tandis que les pôles égaux se repoussent. Les pôles positifs ou Δ + sont représentés ci-dessus avec la couleur bleue, mais les pôles négatifs ou δ- sont représentés avec la couleur rouge.
Notez comment les molécules supérieures sont orientées et ordonnées de telle manière que les pôles opposés sont, en s'éloignant dans le processus aux mêmes pôles. Cet ordre est ce que l'on appelle les interactions ou les forces dipolo-dipolo (forces Keesom), et sont les forces intermoléculaires les plus importantes entre les molécules polaires.
Par exemple, les molécules H2Ou, HCL, HF, CO, entre autres, ils sont ordonnés dans des modes similaires. Plus ils sont polaires, plus ses forces dipol-dipolo seront fortes; Et par conséquent, il sera plus difficile de séparer leurs molécules.
Le HF est plus polaire que le HCL, donc le point d'ébullition du HF est supérieur (19.5 ºC) au HCl (-85.05 ºC). C'est incroyable l'effet que les forces intermoléculaires ont sur les propriétés physiques. La plus petite variation, et la substance se comportera totalement différente de ce qui était attendu.
Peut vous servir: État gazeux: caractéristiques, loi générale, exemplesDipolo-dipolo induit (Debye)
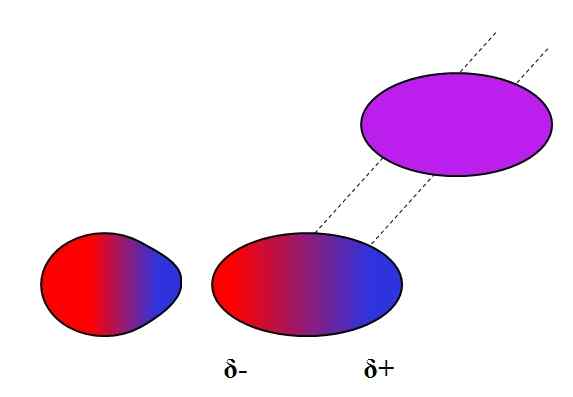 Dipolo-dipolo induit. Source: Gabriel Bolívar.
Dipolo-dipolo induit. Source: Gabriel Bolívar. Les dipolos, comme les ions, peuvent également fluctuer ou affecter la distribution électronique des atomes ou des molécules neutres. Ainsi, nous voyons, dans l'image supérieure, qu'un dipôle polarise soudainement une molécule neutre. On dit donc qu'il s'agit d'une force dipolaire dipolaire induite, car le deuxième dipôle est momentané, pas permanent.
Par exemple, l'eau est capable de dissoudre une petite quantité de ou2, Mais assez pour que la faune marine respire. Si H2Ou ne pouvait pas induire de dipôle dans le O2, Tout l'oxygène des mers échapperait à la surface, car il n'y aurait pas d'interactions entre les deux molécules.
Dipolo instantané induit par Dipolo (Londres)
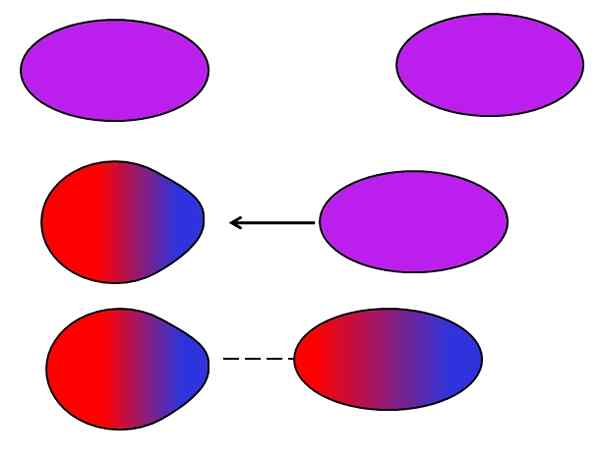 Forces de Londres. Source: Gabriel Bolívar.
Forces de Londres. Source: Gabriel Bolívar. Les atomes ou molécules neutres n'ont pas besoin d'ions ou de dipôles voisins pour souffrir pour eux-mêmes des fluctuations dans la distribution de leurs charges internes. Les électrons ne sont pas encore, mais se déplacent dans la molécule. À un moment donné, un dipôle instantané aura lieu, qui s'il est très proche d'une molécule ou d'un atome neutre, induira un dipôle (voir ci-dessus).
Plus ces molécules plus grandes et asymétriques, plus les dipôles instantanés se produiront probablement. C'est pourquoi les composés des masses atomiques les plus élevées ont un induit induit induit par des forces dipol. Ce type de forces de van der Waals est mieux connu sous le nom de forces de Londres.
Par exemple, des gaz nobles (lui, ne, ar, etc.) Ils restent unis grâce aux forces de Londres, tout comme les gaz aériens (ou2, N2, CO2, etc.). De plus, cette force est la plus prédominante parmi les hydrocarbures tels que le méthane, Cho4, Et propane, Cho3Ch2Ch3.
Forces hydrophobes
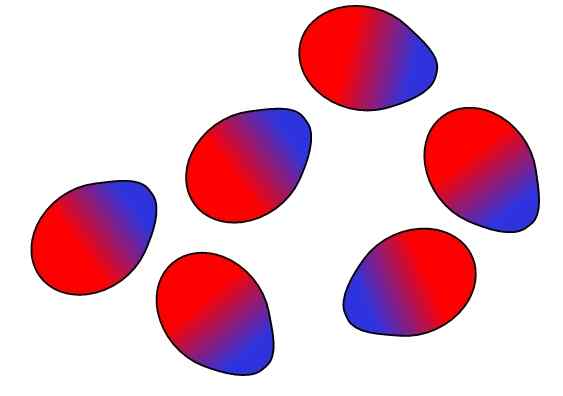
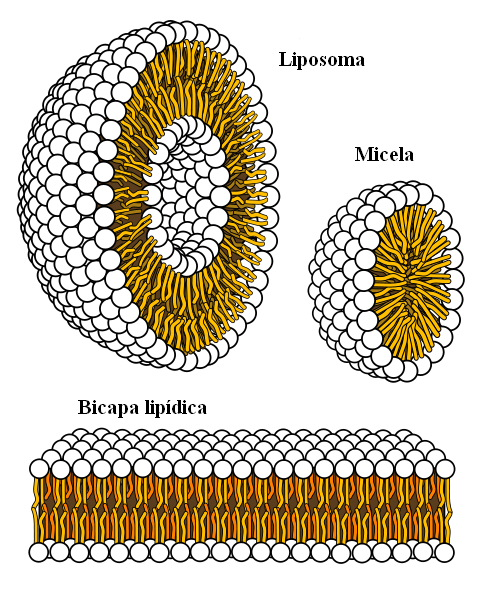 Des structures supramoléculaires provenaient de forces hydrophobes
Des structures supramoléculaires provenaient de forces hydrophobes Enfin, nous avons des forces hydrophobes, qui sont un résultat spécial des forces de Londres et des répulsions entre des substances avec différentes polarités. Les graisses sont peu liées à l'eau, donc elle est insoluble dans ce.
Les molécules de graisse cherchent à se regrouper de manière à ce que leurs interactions avec l'eau soient autant que possible, et cela parvient à former des structures 3D comme celles indiquées ci-dessus.
Ainsi, les molécules de graisse, telles que les phospholipides, se réunissent pour former des bicouches lipidiques, des micelles et des liposomes.
S'ils sont observés, ces molécules ont une tête blanche qui représente une partie polaire, liée à l'eau; ainsi qu'une queue apolaire, qui repousse les molécules d'eau. Les lignes cherchent à se placer à l'intérieur de ces structures supramoléculaires, afin qu'elles n'interagissent pas avec l'eau.

