Caractéristiques de la proline, structure, fonctions, nourriture
- 841
- 46
- Lucas Schneider
La Proline (Pro, p) appartient aux 22 acides aminés classés comme basiques. C'est un acide aminé non essentiel, car il peut être synthétisé par l'homme et d'autres animaux de mammifères.
En 1900, le scientifique allemand Richard Willstatter a été le premier à extraire et à observer la proline. Cependant, c'est Emili Fischer, en 1901, qui a inventé le terme "proline" basé sur l'anneau de pyrrolidine de l'acide aminé; Ce chercheur a également réussi à expliquer en détail la synthèse de la proline de la caséine du lait.
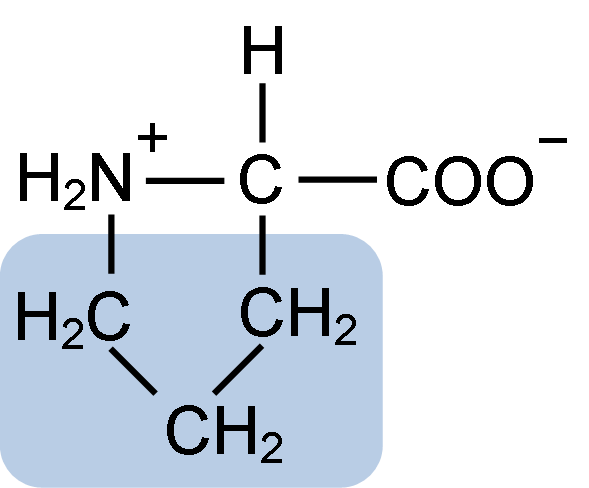
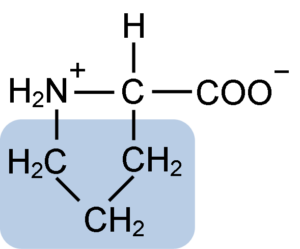 Structure chimique de l'acide aminé proline (Source: Clavecine [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Structure chimique de l'acide aminé proline (Source: Clavecine [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Dans des protéines telles que la caséine, la proline a une fonction indispensable dans les "virages" et le repliement structurel. Dans cette protéine, la proline est distribuée de manière homogène dans toute la structure et se lie à la caséine β et à la protéine αS1; De plus, il empêche les boucles structurelles défectueuses ou le pliage.
Dans les analyses biochimiques utilisées actuellement pour déterminer la séquence exacte d'acides aminés qui composent les protéines, la proline est l'un des acides aminés de détection les plus difficiles, car le groupe amino secondaire de la proline a un comportement différent et ne peut pas être facilement détecté.
Le scorbut est peut-être la maladie la plus connue liée à la proline. Cela a à voir avec une carence en apport en vitamine C, ce qui affecte directement l'hydroxylation de la proline dans les fibres de collagène, ce qui provoque un affaiblissement systémique en raison de l'instabilité des fibres de collagène qui se trouvent dans tout le corps.
[TOC]
Caractéristiques
Le groupe amino secondaire lié au carbone α rend la tâche de classification de la proline quelque peu difficile. Cependant, dans certains textes, il est classé à côté des acides aminés ramifiés ou avec des chaînes latérales aliphatiques, car la chaîne latérale ou le r r de la proline est hydrophobe ou aliphatique.
L'une des caractéristiques les plus importantes de la proline est que, en aucun cas, les ponts hydrogène ne peuvent se former, ce qui rend idéal pour structurer des virages complexes et complexes dans les structures tertiaires des protéines.
Tout comme tous les acides aminés ont deux isoformes qui dépendent de l'atome de carbone central, la proline peut être trouvée dans la nature telle que L-Proline ou en tant que d-prolol. Cependant, la forme L-Prolina est la nature la plus abondante et qui fait partie des structures protéiques.
Dans les protéines où elle est située, la proline occupe fréquemment des endroits à proximité de la surface ou du pli ou du «virage» de la chaîne polypeptidique, car la structure rigide et fermée de la proline rend une interaction forte avec d'autres interactions en acides aminés difficiles.
Structure
La proline a une structure particulière entre les acides aminés de base, car il présente un groupe amino (NH2) secondaire et non le groupe aminé principal qui est caractéristique de tous les acides aminés.
Le groupe R ou la chaîne latérale de la proline est un anneau de pyrrolidine ou de tétrahydropirrol. Ce groupe est formé par une amine hétérocyclique (pas de double liaisons) de cinq atomes de carbone, où chacun est saturé d'atomes d'hydrogène.
La proline a la particularité selon laquelle l'atome de carbone "central" est inclus dans le cycle pyrolidine hétérocyclique, de sorte que les seuls atomes "libres" ou "exceptionnels" sont le groupe carboxyle (COOH) et l'atome d'hydrogène (H) de l'anneau hétérocyclique de l'acide aminé.
Peut vous servir: Superoxyde Dysmutase: Caractéristiques, structure, fonctionsLa formule moléculaire de la proline est C5H9NO2 et son nom IUPAC est l'acide pirrolidine-2-carboxylique. Il a un poids moléculaire approximatif de 115,13 g / mol et sa fréquence d'apparence dans les protéines est d'environ 7%.
Les fonctions
Les fibres de collagène et de tropocollagène sont les protéines les plus abondantes chez la plupart des animaux vertébrés. Ceux-ci constituent la peau, les tendons, la matrice osseuse et de nombreux autres tissus.
Les fibres de collagène sont composées de nombreux déclencheurs de triple polypeptide qui, à leur tour, sont composés de multiples résidus de proline et de glycine dans la glycine-practoline-proline / séquence d'hydroxiprololine (ce dernier est un dérivé modifié de la proline).
Dans sa forme indigène, la proline fait partie du procollagène, ce qui est un précurseur des polypeptides du collagène et de certaines autres protéines du tissu conjonctif. L'enzyme proline hydroxylase.
Quelle est la fonction principale de la proline dans les fibres de collagène?
L'hydroxyproline donne des caractéristiques de résistance au collagène, car ce dérivé d'acides aminés a la capacité de former un grand nombre de ponts d'hydrogène entre les chaînes à trois hélices qui composent la protéine.
Les enzymes qui catalysent l'hydroxylation des déchets proline nécessitent la présence de vitamine C (acide ascorbique) et, comme mentionné ci-dessus, le scorbut est dû à l'affaiblissement des fibres de collagène dues à des échecs dans l'hydroxylation des déchets de proline, ce qui entraîne une diminution de la diminution de ponts d'hydrogène qui soutiennent les fibres de collagène.
Autres fonctions
La proline est indispensable pour la formation de plis et de virages en protéines.
Sa structure fermée rend cet acide aminé difficile à "accueillir" les protéines intérieures, en outre, car il ne peut pas former des ponts d'hydrogène pour "interagir" avec d'autres déchets à proximité, il induit la formation de "virages" ou "tourne" le long de la structure des protéines où il est situé.
Toutes les protéines avec une courte durée de vie ont au moins une région avec une proline répétée abondante, du glutamate, de la sérine et de la treonine. Ces régions vont de 12 à 60 déchets et sont appelées séquences de ravageurs.
Les protéines contenant la séquence des ravageurs sont marquées par l'ubiquitination pour la dégradation ultérieure des protéosomes.
Biosynthèse
De nombreux acides aminés peuvent être synthétisés à partir d'intermédiaires de glycolyse, du pentose phosphate ou du cycle d'acide citrique (cycle de Krebs). La proline et l'arginine se forment sur les routes courtes du glutamate.
La voie biosynthétique pratiquement courante pour tous les organismes vivants commence par la conversion du l-glutamate dans le γ-L-glutamil-5-phosphate grâce à l'action de l'enzyme de glutamate-5-quais (en bactéries) ou par la γ-glutamil - Whinas (chez l'homme).
Cette réaction implique une phosphorylation dépendante de l'ATP, donc, en plus du produit principal, une molécule ADP est générée.
La réaction catalysée par le glutamate 5-sémi-limide déshydrogénase (chez les bactéries) ou par le phosphate de γ-glutamil réductase (chez l'homme) convertit le γ-L-glutamil-5-phosphate en L-glutamate-5-sémidé Co -facteur NADPH.
Peut vous servir: à moitié Stuart: fondation, préparation et utilisationsLe L-glutamato-5-semialdéhyde est réversible et spontanément déshydraté en (S) -1-1-pyrrool), dans la réaction duquel une molécule de NADPH ou NADH est également nécessaire.
Dégradation
La proline, l'arginine, la glutamine et l'histidine sont constamment dégradées en α-zétoglutarate pour entrer dans le cycle du cycle de l'acide citrique ou du krebs. Dans le cas particulier de la proline, cela est d'abord oxydé par l'enzyme de la proline oxydase à la pirroline-5-carboxylate.
Dans la première étape, où l'oxydation de la proline en pirroline-5-carboxylate se produit, les protons détachés sont acceptés par la FAD E, réduisant en e-FADH2; Cette étape est exclusive à l'acide aminé proline.
En raison d'une réaction spontanée, la pirroline-5-carboxylate est transformée en glutamate γ-sémialdéhyde, qui sert ensuite de substrat pour le glutamate enzymatique γ-sémi-limidique déshydrogénase. À cette étape, deux protons émergent, l'un d'eux est accepté par le NAD qui est réduit à NADH, et l'autre est libre sous la forme de H+.
L'arginine, comme la proline, est transformée en glutamate γ-sémialdéhyde, mais par une voie métabolique alternative dans laquelle deux enzymes différentes participent.
L'enzyme déshydrogénase du glutamate γ-sémialdéhyde γ transforme le glutamate γ-semialdéhyde en l-glutamate. Par la suite, ce L-glutamate est à nouveau oxydé par une glutamate déshydrogénase enzymatique, qui forme enfin le α-zétoglutarate qui sera incorporé dans le cycle d'acide citrique.
Dans le passage d'oxydation du glutamate, un proton (H +) est libéré et un groupe amino (NH3 +). Le proton réduit un groupe NADP + et une molécule NADPH provient.
Malgré les nombreuses similitudes qui existent entre les voies de dégradation et de biosynthèse de la proline et de l'arginine, ces acides aminés sont synthétisés et dégradés par des voies totalement opposées qui utilisent différentes enzymes, différents cofacteurs et qui se produisent différents compartiments intracellulaires.
Aliments riches en Valina
En général, tous les aliments à haute teneur en protéines ont de grandes quantités de proline. Parmi ceux-ci figurent la viande, le lait, les œufs et autres. Cependant, lorsque notre corps est dans un état de santé et de nutrition optimal, il est capable de synthétiser la proline endogène.
La proline peut également être trouvée dans de nombreuses légumineuses et noix et dans des grains entiers tels que la farine d'avoine, par exemple. Les autres aliments proline sont le son de blé, les noix, les amandes, les pois, les haricots, entre autres.
Certains magasins de naturistes forment généralement comprimés à partir des acides aminés L-Lisina et L-Proline combinés pour aider les personnes ayant des problèmes articulaires ou pour retarder le vieillissement des tissus.
Cependant, il n'a pas été démontré avec certitude que l'ingestion de compléments alimentaires de ces acides aminés a un effet significatif sur le retard de la vieillesse ou d'autres conditions de l'avance de l'âge.
Avantages de votre apport
Les régimes riches en proline sont généralement prescrits pour les personnes atteintes de maladies articulaires telles que l'arthrite, les entorses, la rupture du ligament, les dislocations, la tendonite et d'autres, ce qui est dû à leur relation avec la synthèse des fibres de collagène présentes dans les tissus connectifs corporels.
Peut vous servir: agar m.R.S: Qu'est-ce que la fondation, la préparation, utiliseDe nombreuses lotions et comprimés pharmacologiques utilisés dans l'industrie esthétique sont enrichis en L-Proline, car certaines études ont montré que cet acide aminé peut en quelque sorte augmenter la synthèse du collagène et, par conséquent, améliorer la texture de la peau, accélérer la guérison des plaies, lacérations, ulcères et brûlures.
Dans l'industrie alimentaire, il existe des protéines qui ont des «peptides bioactifs» qui font des fonctions au-delà de leurs propriétés nutritionnelles. Ces peptides ont généralement deux à neuf déchets d'acides aminés parmi lesquels la proline, l'arginine et la lysine abondent.
Ces peptides bioactifs peuvent avoir une activité antihypertense avec un certain effet opioïde; Ils peuvent agir en tant qu'immunomodulateurs en stimulant la réponse immunitaire contre certains agents pathogènes et peuvent même provoquer une augmentation de la vasoactivité, ce qui améliore la circulation de ceux qui les consomment.
Troubles de la carence
Le gluten est une protéine présente dans les grains de blé qui provoque une inflammation de l'intestin. Les personnes qui souffrent de «l'intolérance au gluten» sont connues sous le nom de patients «cœliaques» et il est connu que cette protéine est riche en proline et en glutamine, dont la dégradation protéolytique est difficile pour les personnes atteintes d'une telle condition.
Certaines maladies ont à voir avec le mauvais repliement des protéines importantes et il est très courant que ces défauts aient à voir avec l'isomérisation Cis-trans des liens d'amida dans les déchets proline, car, contrairement à d'autres liens peptidiques dans lesquels l'isomère trans Il est très favorisé, dans la proline, il est désavantagé.
Dans les déchets de proline, il a été observé qu'il existe une tendance significative à la formation de l'isomère Cis Premier que l'isomère trans Dans les amides adjacents des déchets proline, qui peuvent générer une conformation "incorrecte" des protéines.
Troubles métaboliques
Comme pour les autres acides aminés essentiels et non essentiels, les principaux troubles pathologiques liés à la proline ont à faire, généralement, avec des défauts sur les voies d'assimilation de cet acide aminé.
L'hyperprolinémie, par exemple, est un cas typique de carence dans l'une des enzymes qui participent à la voie de dégradation de la proline, en particulier à la 1-pyroline-5-carboxylate déshydrogénase, ce qui conduit à une accumulation de son substrat, qui inactive finalement l'itinéraire.
Cette pathologie est généralement diagnostiquée par des teneurs proline élevées dans le plasma sanguin et par la présence du métabolite 1-pyrrololine-5-carboxylate dans l'urine des patients touchés affectés.
Les principaux symptômes de cette maladie sont des troubles neurologiques, des maladies rénales et une perte de capacité auditive ou de surdité. D'autres cas plus graves incluent un délai mental sévère et des difficultés psychomotrices marquées.
Les références
- Abu-Baker, S. (2015). Revue de la biochimie: concepts et connexions
- Delauney, un. J., & Verma, D. P. S. (1993). Proline biosynthèse et osmorégulation chez les plantes. The Plant Journal, 4 (2), 215-223.
- Liste, b., Lerner, R. POUR., & Barbas, C. F. (2000). Réactions d'aldol asymétriques directes catalysées par la proline. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Plimmer, R. H. POUR. (1912). La constitution chimique des protéines (vol. 1). Longmans, vert.
- Szabados, L., & Savouré, à. (2010). Proline: un acide aminé multifonctionnel. Trends in Plant Science, 15 (2), 89-97.
- « Méthode Tachtenberg Qu'est-ce que, des exemples
- Caractéristiques du typtophane, structure, fonctions, avantages »

