Caractéristiques du typtophane, structure, fonctions, avantages
- 4821
- 1376
- Jade Duval
Il Tryptophane (Trp, w) est un acide aminé classé dans le groupe d'acides aminés essentiels, car l'organisme humain ne peut pas le synthétiser et doit l'obtenir à travers le régime.
Certains aliments tels que le lait et leurs dérivés, les viandes, les œufs et certaines céréales tels que le quinoa et le soja contiennent des acides aminés essentiels et, par conséquent, sont une source importante de tryptophane.
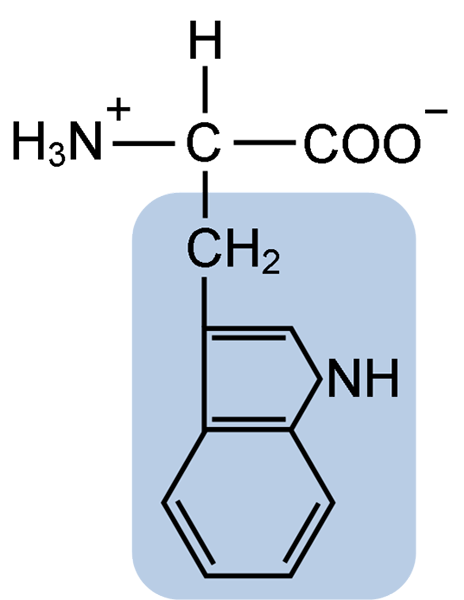
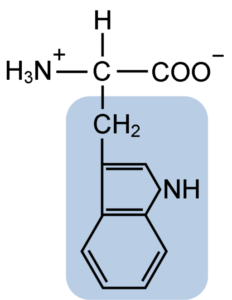 Structure chimique de l'acide aminé typtophane (Source: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Structure chimique de l'acide aminé typtophane (Source: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) De nature, plus de 300 acides aminés différents sont connus et seulement 22 constituent les unités monomères des protéines cellulaires. Parmi ces derniers, 9 sont des acides aminés essentiels, y compris le tryptophane, cependant, l'essentialité de chacun diffère entre une espèce et une autre.
Le tryptophane a diverses fonctions, parmi lesquelles leur participation à la synthèse des protéines, dans la synthèse de la sérotonine, qui est un puissant vasoconstricteur et neurotransmetteur, de la mélatonine et dans la synthèse du co-fondateur NAD.
Dans le royaume végétal, le tryptophane est un précurseur fondamental de l'hormone végétale connue sous le nom d'auxine (acide indole-3-acétique). Il peut être synthétisé par certaines bactéries telles que ET. coli Du corismato, qui est produit à partir de certains dérivés glycolytiques tels que le phosphoenolpiruvate et l'érythrosa-4-phosphate.
Sa dégradation chez les mammifères se produit dans le foie, où elle est utilisée pour la synthèse de l'acétyl coenzyme A (acétyl-CoA), et pour cette raison, il est décrit comme un acide aminé appelle glucogénique, car il peut entrer dans le cycle de formation du glucose.
Diverses études ont été rapportées avec des résultats controversés liés à l'utilisation du tryptophane comme complément alimentaire pour le traitement de certaines pathologies telles que la dépression et certains troubles du sommeil entre autres.
Il existe certaines maladies liées aux anomalies congénitales dans le métabolisme des acides aminés. Dans le cas du typtophane, la maladie de Hartnup peut être nommée, en raison du tryptophane -2,3-monoxigénase, une maladie héréditaire récessive caractérisée par un retard mental et des altérations du type de pélagra de type peau.
[TOC]
Caractéristiques
Avec la phénylalanine et la tyrosine, le tryptophane se trouve dans le groupe d'acides aminés aromatiques et hydrophobes.
Cependant, le tryptophane se caractérise par un acide aminé légèrement hydrophobe car sa chaîne latérale aromatique, en ayant des groupes polaires, atténue cette hydrophobicité.
Pour avoir des anneaux combinés, ils ont une forte absorption de la lumière dans la région du spectre proche de l'ultraviolet et cette caractéristique est fréquemment utilisée pour l'analyse structurelle des protéines.
Il absorbe la lumière ultraviolette (entre 250 et 290 nm) et, bien que cet acide aminé ne soit pas très abondant dans la structure de la plupart des protéines du corps humain, sa présence représente une contribution importante pour la capacité d'absorption de la lumière de la lumière dans la région de la région de la région 280 nm de la plupart des protéines.
Les exigences quotidiennes du tryptophane diffèrent avec l'âge. Chez les nourrissons entre 4 et 6 mois, l'exigence moyenne est d'environ 17 mg par kilogramme de poids par jour; Chez les enfants âgés de 10 à 12 ans, il est de 3,3 mg par kilogramme de poids par jour et chez les adultes, il est de 3,5 mg par kilogramme de poids par jour.
Le tryptophane est absorbé par la route intestinale et est un acide aminé cétogène et glycogène en même temps.
Comme il s'agit d'un précurseur de sérotonine, un neurotransmetteur important, le tryptophane doit atteindre le système nerveux central (SNC) et pour cela, il doit traverser la barrière du cerveau sanguin, pour lequel il existe un mécanisme de transport actif spécifique.
Peut vous servir: Agar Biggy: fondation, préparation et utilisationsStructure
Le tryptophane a une formule moléculaire C11H12N2O2 et cet acide aminé essentiel a une chaîne latérale aromatique.
Comme tous les acides aminés, le tryptophane a un atome de carbone α attaché à un groupe amino (NH2), un atome d'hydrogène (H), un groupe carboxyle (COOH) et une chaîne latérale (R) formée par une structure hétérocyclique, le groupe Indol.
Son nom chimique est l'acide 2-amino-3 propionique, il a une masse moléculaire de 204,23 g / mol. Sa solubilité à 20 ° C est de 1,06 g dans 100 g d'eau et a une densité de 1,34 g / cm3.
Les fonctions
Dans l'être humain, le tryptophane est utilisé pour la synthèse des protéines et est indispensable pour la formation de sérotonine (5-hydroxitriptamine) un puissant vasoconstrictor, stimulant la contraction musculaire lisse (en particulier dans la dépression intestinale) et un neurotransmetteur capable de générer une stimulation psychique de génération, de combattre la dépression de combat et réguler l'anxiété.
Le tryptophane est un précurseur de la synthèse de la mélatonine et, par conséquent, a des implications dans les cycles du sommeil et de la veille.
Ledit acide aminé est utilisé comme précurseur dans l'une des trois façons de la formation du cofacteur NAD, un cofacteur très important qui participe à une variété de réactions enzymatiques liées aux événements d'oxyde d'événements de réduction de l'oxyde.
Le tryptophane et certains de ses précurseurs sont utilisés pour la formation d'une hormone végétale appelée Auxin (acide Indol-3-actif). Les auxines sont des hormones végétales qui régulent la croissance, le développement et de nombreuses autres fonctions physiologiques des plantes.
Biosynthèse
Dans les organismes capables de le synthétiser, le squelette de carbone du tryptophane dérive du phosphoenolpyruvate et de l'érythrosa-4-phosphate. Ceux-ci, à leur tour, sont formés à partir d'un intermédiaire du cycle de Krebs: oxalacétate.
Le phosphoenolpiruvate et l'érythrous-4-phosphate sont utilisés pour la synthèse du corisme sur une voie enzymatique à sept. Le phosphoenolpiruvate (PEP) est un produit de la glycolyse et du phosphate érythreux-4 de la route du pentose phosphate.
Comment est la route de synthèse du corisme?
La première étape des symptômes du corismato est l'union du PEP avec l'érythrosa-4-phosphate pour former le 2-ZO-3-Disoxxi-d-anabino-heptulosonato-7-phosphate (DAHP) (DAHP).
Cette réaction est catalysée par l'enzyme 2-zo-3-dexxi-d-anabino-heptulosonato-7-phosphate synthase (DAHP syntasa), qui est inhibée par le coristique.
La deuxième réaction implique la ciclation du DAHP par la déshydrochinat de synthase, une enzyme qui nécessite le NAD de co -facteur, qui est réduit pendant cette réaction; En conséquence, le 5-dishydroquine se produit.
La troisième étape de cette voie implique l'élimination d'une molécule d'eau de 5 déshydroquinée, réaction catalysée par la déshydratase enzymatique déshydratase, dont le produit final correspond au shikimato 5-dishydro.
Le groupe céto de cette molécule est réduit à un groupe hydroxyle et, par conséquent, le shikimato est formé. L'enzyme qui catalyse cette réaction est la dépendance dépendante du NADPH.
La cinquième étape de l'itinéraire implique la formation de shikimate 5-phosphate et la consommation d'une molécule d'ATP par une enzyme connue sous le nom de kinase Shikimato, en charge de la phosphorylation de Shikimate en position 5.
Par la suite, à partir de 5-phosphate shikimate et par l'action de la synthase Shikimato-5-phosphate à 3-enlappiruvil, le shikimato à 3-enlappiruvil 5-phosphate est généré. L'enzyme susmentionnée favorise le déplacement du groupe phosphoryle d'une deuxième molécule de PEP par le groupe hydroxyle de carbone en position 5 de 5-phosphate shikimate.
Cela peut vous servir: pourquoi est-il important de prendre soin de la biodiversité?La septième et dernière réaction est catalysée par le corisme de synthase, qui élimine le phosphate du shikimate 5-phosphate à 3-enlappates et le fait du corisme.
Dans le champignon N. Crassa, Un seul complexe enzymatique multifonctionnel catalyse cinq des sept réactions de cette route et ce complexe s'ajoutent trois autres enzymes qui finissent par générer du tryptophane.
Synthèse du tryptophane dans les bactéries
Dans ET. coli, La transformation du corisme tryptophane comprend une voie enzymatique supplémentaire:
Premièrement, l'enzyme antranilate synthase convertit le coristique en antranilate. Dans cette réaction, une molécule de glutamine participe, donnée par le groupe amino qui se lie à l'anneau indol du tryptophane et devient glutamate.
La deuxième étape est catalysée par l'antranilate de phosphorribosyl transférase. Dans cette réaction, une molécule de pyrophosphate du 5-phosphorribosyl-1-pyrophosphate (PRPP) (PRPP) se déplace riche en énergie, et le n- (5'-phosphorribosyl) est formé.
La troisième réaction de cette route de synthèse du tryptophane implique la participation de l'enzyme phosphorribosyl-isomérase. Ici le n- (5'-phorribosyl) -santhranylate.
Plus tard, le phosphate d'indole-3-glycérol est formé, dans une réaction catalysée par la sympathie indol-3-glycérol synthase, où un CO2 et une molécule H2O sont libérés et le 1- (O-carboxyphénylamine) -1- desoxyribulosa 5-phosphate.
La dernière réaction de cette route finit par former du tryptophane lorsque la tryptophane synthase catalyz.
Dégradation
Chez les mammifères, le tryptophane est dégradé dans le foie à l'acétyl-CoA sur une voie qui implique douze étapes enzymatiques: huit pour atteindre α-zo-soadipate et 4 autres pour convertir le α-zo-dotadipato en acétyl coenzyme en α-zo-dotadipato en acétyle coenzyme en.
L'ordre de dégradation jusqu'à α-cetoadipato est:
Typtophane → N-Quinurenine formil → quinurénine → 3-hydroxi quinurenine → 3-hydroxy-antranilate → ε-sémialdéhyde 2-amino-3-muconcycix.
Les enzymes qui catalysent respectivement ces réactions sont:
Typtophane 2-3-dioxigénase, formamidase quinurenine, NADPH-dépendant de la monooxigénase NADPH.
Une fois l'α-cesthoadipate généré, la décarboxylation oxydative est formée gludéré-CoA. Ceci, par ß-oxydation, la forme de glutaconyl-CoA qui perd un atome de carbone bicarbonate (HCO3-), gagne une molécule d'eau et se termine sous forme de crotonil-coa.
Crotonil-CoA, également pour ß-oxydation, donne l'acétyl-CoA. Ledit acétyl-CoA peut suivre plusieurs voies, parmi lesquelles la gluconéogenèse, pour former du glucose et du cycle de Krebs, pour former l'ATP, si nécessaire, si nécessaire.
Cependant, cette molécule peut également être dirigée vers la formation de corps cétone, qui peuvent enfin être utilisés comme source d'énergie.
Aliments riches en tryptophane
Les viandes rouges en général, le poulet et le poisson (en particulier le poisson bleu comme le saumon et le thon) sont particulièrement riches en tryptophane. Le lait et ses dérivés, les œufs, en particulier le jaune, sont également des aliments avec beaucoup de teneur en tryptophane.
Les autres aliments qui servent de source naturelle de cet acide aminé sont:
- Des noix comme les noix, les amandes, les pistaches et les anacardos, entre autres.
- Céréales de riz.
- Grains secs comme les haricots, les lentilles, les pois chiches, le soja, le quinoa, etc.
- Levure à bière et haricots frais, bananes et bananes, ananas ou ananá, avocat, prunes, cresson, brocoli, épinards et chocolat.
Il peut vous servir: Shark sous-marin: histoire, réalité ou fiction?Avantages de votre apport
La consommation de typtophane est absolument nécessaire pour synthétiser toutes ces protéines qui l'incluent dans sa structure et à travers ses différentes fonctions, il permet de réguler l'humeur, le sommeil et les cycles de veille et une grande variété de processus biochimiques dans lesquels NAD participe.
En plus des effets connus sur l'humeur, la sérotonine (dérivée du tryptophane) intervient dans plusieurs fonctions cognitives liées à l'apprentissage et à la mémoire qui, par conséquent, sont également liées au tryptophane.
Il existe des données qui montrent la relation entre l'humeur, la sérotonine et l'axe gastro-intestinal-cérébral comme système d'influences bidirectionnelles entre les centres émotionnels et cognitifs du cerveau et la fonction périphérique du tractus digestif.
L'utilisation comme complément alimentaire pour le traitement de certains troubles, en particulier celles liées au système nerveux central, a été très controversée parce que son transport concurrentiel avec des acides aminés neutres, beaucoup plus abondants, rend difficile l'atteinte d'obtenir une augmentation significative et soutenue du tryptophane après après après après après après après après après après après la Son administration orale.
Malgré ces controverses, son utilisation a été postulée en complément:
- Traitement de la douleur
- Problèmes de sommeil
- Traitement de la dépression
- Traitement de la manie
- Réduction de l'appétit
Troubles de la carence
L'élimination centrale ou le manque de tryptophane s'accompagne de dépression, de défaillances de l'attention, de diminution de la mémoire, du sommeil et des troubles anxieux.
Chez les patients déprimés et avec des tendances suicidaires, des altérations de la concentration du sang et du liquide céphalorachidien ont été trouvées. De plus, certains patients atteints d'anorexie nerveuse présentent de faibles taux sériques de tryptophane.
Certains patients polyuriques, qui perdent de la vitamine B6 et du zinc, ont souvent des phobies et de l'anxiété et s'améliorent avec des compléments alimentaires riches en triptophane.
Le syndrome carcinoïde se caractérise par la présence de petites tumeurs intestinales qui provoquent la diarrhée, les maladies vasculaires et la bronchoconstriction et est liée au déficit de niacine et de tripophane
Le pélagra est une condition pathologique qui s'accompagne de diarrhée, de démence, de dermatite et peut provoquer la mort, cela est également traité avec des suppléments de niacine et de tryptophane.
La maladie de Hartnup doit faire, parmi certaines choses, avec un défaut du métabolisme de plusieurs acides aminés, y compris le tryptophane.
Dans le cas par déficit de l'enzyme typtophane -2,3-monoxigénase, il s'agit d'une maladie héréditaire récessive caractérisée par un retard mental et des altérations cutanées de type peau.
Les références
- Halvorsen, k., & Halvorsen, s. (1963). Maladie de Hartnup. Pédiatrie, 31(1), 29-38.
- Capuche, s. D., Cloche, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). La panique de Don. Un guide de l'épuisement du tryptophane avec une provocation d'anxiété spécifique aux troubles. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. POUR., Nguyen, J. C., Polglaze, k. ET., & Bertrand, P. P. (2016). Influence du tryptophane et de la sérotonine sur l'humeur et la cognition avec un rôle possible de l'axe intestinal. Nutriments, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. POUR., Fernstrom, J., Fernstrom, m.,… & Kishore, un. (2003). Effets anxiolytiques de l'épuisement aigu du tryptophane dans l'anorexie mentale. Journal international de troubles de l'alimentation, 33(3), 257-267.
- Murray, R. K., Granner, D. K., Mayes, P., & Rodwell, V. (2009). Biochimie illustrée de Harper. 28 (p. 588). New York: McGraw-Hill.
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- « Caractéristiques de la proline, structure, fonctions, nourriture
- Catalaps causes, symptômes et traitement »

