Précipité

- 3425
- 658
- Louna Baron
Nous expliquons ce qu'est un précipité, la réaction de précipitation, les types qui existent et donnent plusieurs exemples
 Formation de précipité jaune lors du mélange d'une solution avec un agent précipitant
Formation de précipité jaune lors du mélange d'une solution avec un agent précipitant Qu'est-ce qu'un précipité?
UN précipité C'est un solide qui est formé à partir d'une solution, soit par la cristallisation d'une substance dissoute, soit par la formation d'une substance insoluble par une réaction chimique.
Le premier cas se produit lorsqu'une substance solide, qui a été initialement dissoute dans un solvant comme l'eau, devient moins soluble. Cela peut arriver quand:
- La température de la solution est diminuée.
- Un agent précipitant est ajouté.
- Un autre solvant est ajouté dans lequel le solide est moins soluble.
Lorsque sa solubilité devient inférieure à sa concentration, la solution devient sursaturée et qu'une réaction de précipitation se produit.
Le deuxième cas se produit après toute réaction chimique qui génère un produit insoluble ou très peu soluble dans le solvant. Une fois que ce produit commence à se former, la solution est rapidement saturée et le solide commence à précipiter.
Réaction de précipitation chimique
La réaction de précipitation est le processus chimique qui conduit à la formation d'un précipité. Selon la façon dont le précipité est formé, la réaction peut être écrite de deux manières différentes:
- Si les précipitations se produisent parce que la solubilité du solide dans le solvant a été réduite (refroidissement ou ajout d'un autre solvant, par exemple), alors la réaction de précipitation implique le soluté et ressemblerait à ceci:

Par exemple, Si l'acétate de sodium se dissout (ch-3Poche) dans l'eau chaude puis autorisée à refroidir, l'acétate de sodium précipitera en fonction de l'équation suivante:

- Si les précipitations se produisent parce qu'un agent précipitant a été ajouté, la réaction de précipitation impliquera à la fois le soluté et l'agent précipitant.
Par exemple, Ions argentés (AG+) Ils peuvent précipiter à partir d'une solution de nitrate d'argent (AGNO3) Ajout d'une solution de chlorure de sodium ou de NaCl (agent précipitant). La réaction de précipitation dans ce cas est donnée par:
Il peut vous servir: chlorure de nickel (NICL2): structure, propriétés, obtention, utilisations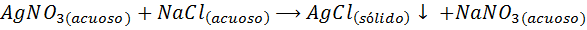
Mécanisme de précipitation
Quelle que soit la réaction de précipitation, la formation du précipité se produit toujours à deux étapes appelées nucléation et croissance:
-
Nucléation
Au début de la réaction de précipitation, de petites particules de précipité se forment qui sont appelées noyaux, donc cette étape est appelée nucléation.
-
Croissance
Après la nucléation, de nouvelles particules ne se forment plus, mais les noyaux déjà formés commencent à croître jusqu'à ce que les précipitations s'arrêtent.
Types de précipité
La vitesse à laquelle se forment les précipités affecte la taille des particules solides et les propriétés de la même. Selon la taille des particules et la nature du composé qui est précipité, trois types de précipités peuvent être distingués:
Précipiter cristallin
C'est le type de précipité le plus simple. Dans ce cas, le précipité est composé de grandes particules solides avec un diamètre supérieur à 0,1 micromètre.
 Précipité cristallin du sulfate de cuivre (II) pentahydrate
Précipité cristallin du sulfate de cuivre (II) pentahydrate Des précipités cristallins se forment lorsque la réaction de précipitation se produit lentement. Cela permet à peu de particules solides de se former pendant la nucléation, et chacune de ces particules a suffisamment de temps pour se développer et former des cristaux gros et lourds qui tombent au fond de la solution.
Ces particules sont presque toujours des solides cristallins avec des visages plats et brillants, similaires aux facettes d'un diamant, et peuvent presque toujours être distingués à l'œil nu.
Précipités
Ils sont précipités pour des particules beaucoup plus petites, entre 0,01 et 0,1 micromètre de diamètre. Ce type de précipité se forme lorsque la réaction de précipitation se produit très rapidement, générant de nombreuses particules pendant la nucléation qui n'ont pas le temps de croître.
En raison de leur taille, ces particules sont très légères et sont en suspension dans la solution formant un colloïde stable. Pour cette raison, ils ne se déposent pas au bas de la solution et il semble nuageux au lieu de transparent.
Peut vous servir: dihydroxyacétone: structure, propriétés, obtention, utilisations Trois casosos de couleurs différentes. Les trois solutions sont troubles après la formation des précipités
Trois casosos de couleurs différentes. Les trois solutions sont troubles après la formation des précipités En plus de cela, les particules sont si petites qu'elles parviennent à traverser la plupart des filtres utilisés pour séparer les précipités des solutions.
Hacords de gelée
Lorsque les particules sont encore plus petites que celles des précipités Caseous, c'est-à-dire, avec des diamètres inférieurs à 0,01 micromètre, les précipités sont appelés gelée. La raison en est que le solide acquiert une apparence similaire à la gélatine ou à une confiture.
Ces précipités sont également considérés comme des colloïdes. En fait, la gélatine est un exemple typique de colloïd, et ces précipités tirent leur nom.
Des exemples caractéristiques de gelée précipittueux sont les oxydes hydratés de certains métaux. Ces oxydes absorbent une grande quantité d'eau à leur surface, ce qui l'empêche de former des particules plus grandes qui cristallisent.
Précipiter des exemples
Acétate de sodium (ch3Poche)
Comme mentionné ci-dessus, l'acétate de sodium peut être précipité à partir d'une solution saturée chaude qui peut refroidir. S'il est autorisé à refroidir lentement, un précipité cristallin se forme dans lequel de longs cristaux d'aiguille blanc sont observés.
Sulfure de cadmium (II) (CDS)
Le sulfure de cadmium est un sel très insoluble qui est immédiatement mélangé dans une solution d'ion de cadmium (II) avec une autre qui contient des ions sulfure.
Sulfate de cuivre (ii) pentahydrate (Cuo4.5h2SOIT)
Lors de la dissolution dans l'eau, le sulfate de cuivre (II) forment des ions hydratés de bleu intense. Si l'eau s'évapore lentement, précipitez de beaux cristaux bleus de cuso4.5h2SOIT. Ces cristaux semblent de pierres précieuses.
Bromure d'argent (AGBR)
Ceci est un exemple d'un composé qui précipite très rapidement en formant un précipité avec des particules très fines qui sont difficiles à filtrer.
Peut vous servir: poids équivalentOxyde hydraté en aluminium (iii) (à2SOIT3.NH2SOIT)
Ceci est un exemple classique de la formation d'un précipité gélatineux. Il est formé lorsqu'une solution de nitrate en aluminium (non (non3)3).
Sulfure de manganèse (II) (MNS)
De nombreux sulfures sont insolubles dans l'eau et le sulfure de manganèse ne fait pas exception. Cela précipite sous la forme d'une très fine poussière.
Chlorure d'argent (AGCL)
Les ions argentés (i) forment très peu de sels solubles avec tous les halogènes. Le cas du chlorure d'argent est un exemple classique de formation précipitée en laboratoire.
Carbonate de calcium (CACO3)
Le calcium est l'un des ions responsables de la dureté de l'eau. Lorsque l'eau qui contient du calcium est chauffée, elle réagit.
Oxyde de fer hydraté (III) (Foi2SOIT3.NH2SOIT)
Ceci est un autre exemple d'un précipité gélatineux qui est formé par la réaction d'une solution contenant des ions fer (iii) avec de l'hydroxyde de sodium ou de potassium.
Hydroxyde de magnésium (mg (OH)2)
Le magnésium est l'autre cation responsable de la dureté de l'eau, car il peut précipiter sous forme d'hydroxyde de magnésium dans les tuyaux et autres systèmes de chauffage de l'eau.
Les références
- Bancoft, W. D. (1918). Aperçu de la chimie des colloïdes.-III. Journal de l'Institut Franklin, 185(3), 373-387. https: // doi.org / 10.1016 / S0016-0032 (18) 90710-6
- Civan, f. (2007). Croissance cristalline et formation d'échelle dans les médias poreux. Dommages de formation du réservoir, 235-255. https: // doi.org / 10.1016 / B978-075067738-7 / 50010-5
- Skoog, D. POUR., Ouest, D. M., Holler, f. J., & Crouch, s. R. (2013). Fondamentaux de la chimie analytique. New York City, New York: Cengage Learning.
- Contributeurs de Wikipedia. (2021, 10 janvier). Précipitations (chimie). Récupéré de.Wikipédia.org

