Caractéristiques, structures et fonctions de la polymérase
- 2896
- 194
- Paul Dumas
Le polymérases Ce sont des enzymes dont la fonction est liée aux processus de réplication et de transcription des acides nucléiques. Il existe deux types fondamentaux de ces enzymes: l'ADN polymérase et l'ARN polymérase.
L'ADN polymérase est responsable de la synthèse de la nouvelle chaîne d'ADN pendant le processus de réplication, ajoutant de nouveaux nucléotides. Ce sont de grandes enzymes complexes et diffèrent dans leur structure selon qu'elle se trouve dans un organisme eucaryote ou dans un procaryote.
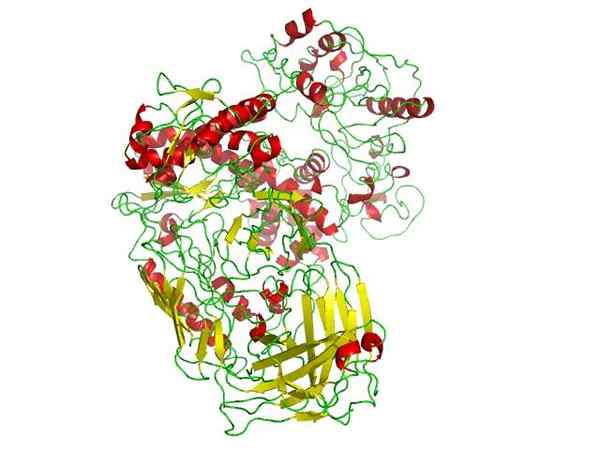
 Taq polymérase: l'enzyme utilisée dans la PCR.
Taq polymérase: l'enzyme utilisée dans la PCR.Source: lijealso [domaine public]
De même, l'ARN polymérase agit pendant la transcription de l'ADN, synthétisant la molécule d'ARN. Comme l'ADN polymérase, il se trouve dans les eucaryotes et les procaryotes et sa structure et sa complexité varient en fonction du groupe.
D'un point de vue évolutif, il est plausible.
[TOC]
Le dogme central de la biologie moléculaire
Le "dogme" de la biologie moléculaire, décrit la formation de protéines des gènes cryptés dans l'ADN en trois étapes: réplication, transcription et traduction.
Le processus commence par la réplication de la molécule d'ADN, où deux copies de celles-ci sont générées de manière semi-conservatrice. Ensuite, le message d'ADN est transcrit à une molécule d'ARN, appelé Messager ARN. Enfin, le messager est traduit en protéines par des machines ribosomales.
Dans cet article, nous explorerons deux enzymes cruciales impliquées dans les deux premiers processus mentionnés.
Il convient de noter qu'il y a des exceptions au dogme central. De nombreux gènes ne se traduisent pas par des protéines, et dans certains cas, le flux d'informations est de l'ARN à l'ADN (comme dans le rétrovirus).
ADN polymérase
Les fonctions
L'ADN polymérase est l'enzyme en charge de la réplication exacte du génome. Le travail enzymatique doit être suffisamment efficace pour assurer le maintien des informations génétiques et sa transmission aux générations suivantes.
Cela peut vous servir: pourquoi est-il important de prendre soin de la biodiversité?Si nous considérons la taille du génome, c'est une tâche assez difficile. Par exemple, si nous soulevons la tâche de transcription un document de 100 page sur notre ordinateur, nous aurons sûrement une erreur (ou plus, selon notre concentration) pour chaque page.
La polymérase peut ajouter plus de 700 nucléotides à chaque seconde, et ce n'est que mal tous les 109 ou 10dix nucléotides construits, un numéro extraordinaire.
La polymérase doit avoir des mécanismes qui permettent à la copiation des informations du génome. Par conséquent, il existe différentes polymérases qui ont la capacité de reproduire et de réparer l'ADN.
Caractéristiques et structure
L'ADN polymérase dans une enzyme qui fonctionne dans une direction de 5 '-3' et fonctionne en ajoutant des nucléotides à l'extrémité terminale avec le groupe libre -OH.
L'une des conséquences immédiates de cette caractéristique est que l'une des chaînes peut être synthétisée sans aucun inconvénient, mais qu'en est-il du brin qui doit être synthétisé dans un sens 3'-5 '?
Cette chaîne est synthétisée dans ce que l'on appelle les fragments d'Okazaki. Ainsi, de petits segments sont synthétisés dans une direction normale, 5'-3 ', qui sont par la suite unis par une enzyme appelée ligase.
Structurellement, l'ADN polymérase a en commun deux sites actifs qui ont des ions métalliques. Nous trouvons l'aspartate et d'autres résidus d'acides aminés qui coordonnent les métaux.
Gars
Traditionnellement, dans les procaryotes, trois types de polymérases ont été identifiés qui sont appelés avec des numéros romains: I, II et III. Dans les eucaryotes, cinq enzymes sont reconnues qui sont appelées avec des lettres de l'alphabet grec, à savoir: α, β, γ, Δ et ε.
Les enquêtes les plus récentes ont identifié cinq types d'ADN dans Escherichia coli, 8 dans le lavage Saccharomyces cerevisiae et plus de 15 dans l'être humain. Dans la lignée des légumes, l'enzyme a été moins étudiée. Cependant, dans l'organisme modèle Arabidopsis thalien Environ 12 enzymes ont été décrites.
Peut vous servir: reproduction asexuéeApplications
L'une des techniques les plus utilisées dans les laboratoires de biologie moléculaire est la réaction en chaîne de PCR ou de polymérase. Cette procédure tire parti de la capacité de polymérisation de polymérisation à amplifier, dans plusieurs ordres de grandeur, une molécule d'ADN que nous voulons étudier.
En d'autres termes, à la fin de la procédure, nous aurons des milliers d'exemplaires de notre ADN blanc.Les utilisations de la PCR sont très variées. Il peut être appliqué à la recherche scientifique, au diagnostic de certaines maladies ou même en écologie.
ARN polymérase
Les fonctions
L'ARN polymérase est responsable de la génération d'une molécule d'ARN basée sur un moule d'ADN. La transcription résultante est une copie qui est complétée au segment d'ADN qui a été utilisé comme moule.
L'ARN messager est chargé d'apporter les informations au ribosome, pour générer une protéine. Ils participent également à la synthèse d'autres types d'ARN.
Cela ne peut pas agir seul, vous avez besoin de protéines appelées facteurs de transcription pour pouvoir exécuter vos fonctions avec succès.
Caractéristiques et structure
Les ARN polymérases sont de grands complexes enzymatiques. Ils sont plus complexes dans la lignée eucaryote que dans le procariota.
Dans les eucaryotes, il existe trois types de polymérases: Pol I, II et III, qui sont les machines centrales pour la synthèse de l'ARN ribosomal, messager et transfert, respectivement. En revanche, dans les procaryotes, tous ses gènes sont traités par un seul type de polymérase.
Différences entre l'ADN et l'ARN polymérase
Bien que les deux enzymes utilisent un tempéré d'ADN, ils diffèrent en trois aspects clés. Premièrement, l'ADN polymérase nécessite un d'abord Pour commencer la réplication et connecter les nucléotides. UN d'abord ou l'amorce est une molécule formée par quelques nucléotides, dont la séquence est complémentaire à un site spécifique de l'ADN.
Peut vous servir: Faune Arequipa: espèces plus représentativesL'amorce donne un -oh à la polymérase pour commencer son processus catalytique. En revanche, les ARN polymérases peuvent commencer leur travail sans avoir besoin d'un d'abord.
Deuxièmement, l'ADN polymérase a plusieurs régions d'union à la molécule d'ADN. L'ARN polymérase ne peut être joint qu'aux séquences de promotion des gènes.
Enfin, l'ADN polymérase est une enzyme qui fait son travail avec une haute fidélité. L'ARN polymérase est sensible à plus d'erreurs, introduisant un mauvais nucléotide tous les 104 nucléotides.
Les références
- Alberts, B., Bray, D., Hopkin, k., Johnson, un. D., Lewis, J., Raff, m.,… & Walter, P. (2015). Biologie cellulaire essentielle. Garland Science.
- Cann, je. K., & Ishino, et. (1999). Réplication de l'ADN archéique: identifier les pièces pour résoudre un puzzle. La génétique, 152(4), 1249-67.
- Cooper, G. M., & Hausman, R. ET. (2004). La cellule: approche moléculaire. Medicinska Naklada.
- Garcia-Diaz, M., & Bébé, k. (2007). Fonctions multiples d'ADN polymérases. Revues critiques dans les sciences des plantes, 26(2), 105-122.
- Lewin, B. (1975). L'expression du gène. UMI Books à la demande.
- Lodish, H., Berk, un., Darnell, J. ET., Kaiser, C. POUR., Krieger, m., Scott, M. P.,… & Matsudaira, P. (2008). Biologie des cellules moléculaires. Macmillan.
- Pierce, b. POUR. (2009). Génétique: une approche conceptuelle. Élégant. Pan -American Medical.
- Shcherbakova, p. V., Bebenek, k., & Kunkel, t. POUR. (2003). Fonctions des ADN polymérases eucaryotes. Sage de la science Ke, 2003(8), 3.
- Steitz, t. POUR. (1999). ADN polymérases: diversité structurelle et mécanismes communs. Journal of Biological Chemistry, 274(25), 17395-17398.
- Wu, s., Barbe, w. POUR., Pedersen, L. g., & Wilson, s. H. (2013). La comparaison structurelle de l'architecture de l'ADN polymérase suggère une passerelle nucléotidique vers le site actif polymérase. Revues chimiques, 114(5), 2759-74.
- « Schémas cognitifs fonctions, caractéristiques et types
- Définition de tension interfaciale, équation, unités et mesure »

