Pepsine
- 3960
- 804
- Noa Da silva
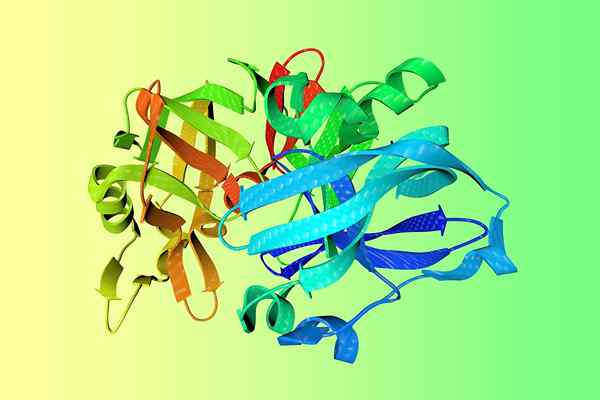
 Structure cristalline de la pepsine
Structure cristalline de la pepsine Qu'est-ce que PpSin?
La pepsine C'est une enzyme puissante présente dans le jus gastrique qui aide à la digestion des protéines. C'est en fait un endopeptida dont la tâche principale est de désintégrer les protéines alimentaires en petites parties appelées peptides, qui sont ensuite absorbées par l'intestin ou dégradées par des enzymes pancréatiques.
Bien qu'il ait été isolé pour la première fois en 1836 par le physiologiste allemand Theodor Schwann, ce n'est qu'en 1929 que le biochimiste américain John Howard Northrop, du Rockefeller Institute for Medical Research, a rapporté sa véritable cristallisation et une partie de ses fonctions, qui l'aiderait à recevoir Le prix Nobel de chimie 17 ans plus tard.
Cette enzyme n'est pas exclusive à l'être humain. Il est également produit dans l'estomac de plusieurs animaux et agit dès les premiers stades de la vie, collaborant dans la digestion des protéines de la laiterie, de la viande, des œufs et des grains, principalement.
Structure de la pepsine
Les principales cellules gastriques produisent une substance initiale appelée pepsinogène. Ce proenzy ou zimogène est hydrolysé et activé par des acides gastriques, perdant 44 acides aminés dans le processus. En fin de compte, la pepsine contient 327 restes d'acides aminés dans sa forme active, qui exerce ses fonctions au niveau gastrique.
La perte de ces 44 acides aminés laisse le même nombre de déchets acides sans. C'est pour cette raison que la pepsine fonctionne mieux dans les médias avec un pH très faible.
Les fonctions
La fonction principale de la ppsine est la digestion des protéines. L'activité de la pepsine est plus élevée dans des environnements très acides (pH 1,5 - 2) et avec des températures allant entre 37 et 42 ºC.
Il peut vous servir: Système Osteon ou Havers: composants, histologie, fonctionsSeule une partie des protéines qui atteignent l'estomac sont dégradées par cette enzyme (environ 20%) formant de petits peptides.
L'activité de la pepsine se concentre principalement sur les liaisons hydrophobes du terminal N présent dans les acides aminés aromatiques tels que le tryptophane, la phénylalanine et la tyrosine, qui font partie de nombreuses protéines des aliments.
Une fonction pepsine décrite par certains auteurs est effectuée dans le sang. Bien que cette déclaration soit controversée, il semble que de petites quantités de pepsine passent à la circulation sanguine, où elle agit sur des protéines grandes ou partiellement hydrolysées qui ont été absorbées par l'intestin grêle avant sa digestion totale.
Comment ça se passe?
Le pepsinogène séparé par les principaux cellules de l'estomac, également connu sous le nom de cellules zimogéniques, est le précurseur de la pepsine.
Cette proenzyme est libérée grâce aux impulsions du nerf vago et à la sécrétion hormonale de la gastrine et de la sécrétion, qui sont stimulées après la consommation alimentaire.
Déjà dans l'estomac, le pepsinogène est mélangé avec de l'acide chlorhydrique, qui a été libéré par les mêmes stimuli, interagissant rapidement les uns avec les autres pour produire la pepsine.
Ceci est réalisé après le fractionnement d'un 44 acides aminés de la structure de pepsinogène d'origine à travers un processus autocatalytique complexe.
Une fois active, la pepsine elle-même est capable de continuer à stimuler la production et la libération de plus de pepsinogène. Cette action est un bon exemple de rétroaction positive enzymatique.
En plus de la pepsine elle-même, l'histamine et en particulier l'acétylcholine stimulent les cellules peptiques pour synthétiser et libérer de nouveaux pepsinogènes.
Peut vous servir: Morison Space: emplacement, anatomie, fonctionsOù agit-il?
Son principal site d'action est l'estomac. Ce fait peut être facilement expliqué en comprenant que l'acidité de l'estomac est la condition idéale pour ses performances (pH 1,5-2,5). En fait, lorsque le bolus alimentaire passe de l'estomac au duodénum, la pepsine est inactive lors de la recherche d'un intestinal moyen avec un pH de base.
La pepsine agit également dans le sang. Bien qu'il ait déjà été dit que cet effet est controversé, certains chercheurs affirment que la pepsine passe au sang, où certains peptides à longue chaîne continuent de creuser ou ceux qui n'ont pas été complètement dégradés.
Lorsque la pepsine quitte l'estomac et se trouve dans un environnement à pH neutre ou de base, sa fonction cesse. Cependant, lorsqu'il n'est pas hydrolysé, il peut être activé à nouveau si le milieu réagit.
Cette caractéristique est importante pour comprendre certains des effets négatifs de la pepsine, qui sont discutés ci-dessous.
Reflux gastro-œsophagien
Le retour chronique de la pepsine vers l'œsophage est l'une des principales causes des dommages causés par le reflux gastro-œsophagien. Bien que les autres substances qui composent le jus gastrique soient également impliquées dans cette pathologie, la pepsine semble être la plus nocive de tous.
La pepsine et d'autres acides présents dans le reflux peuvent provoquer non seulement une œsophagite, ce qui est la conséquence initiale, mais aussi affecter de nombreux autres systèmes.
Parmi les conséquences potentielles de l'activité de la pepsine sur certains tissus, nous avons la laryngite, la pneumonite, le rhum chronique, la toux persistante, le laryngospasmos et même le cancer du larynx.
L'asthme par la microospiration pulmonaire de la teneur gastrique a été étudié. La pepsine peut avoir un effet irritatif sur l'arbre bronchique et favoriser la constriction du chemin respiratoire.
Peut vous servir: os pariétal: anatomie, considérations pathologiquesAutres effets de la pepsine
Les sphères orales et dentaires peuvent également être affectées par l'action de la pepsine. Les signes les plus fréquents associés à ces dommages sont l'halitose ou la mauvaise haleine, la salivation excessive, les granulomes et l'érosion dentaire. Cet effet érosif se manifeste généralement après des années de reflux et peut nuire à toute la prothèse.
Malgré cela, la pepsine peut être utile du point de vue médical. Ainsi, la présence de pepsine en salive est un marqueur diagnostique important du reflux gastro-œsophagien.
En fait, il existe un test rapide disponible sur le marché appelé Peptest, qui détecte la présence de pepsine salivar et aide au diagnostic du reflux.
La papaïne, une enzyme très similaire à la pepsine présente dans les papayes ou les lits, est utile dans l'hygiène et le blanchiment dentaire.
De plus, la pepsine est utilisée dans l'industrie du cuir et la photographie classique, ainsi que dans la production de fromages, de céréales, de collations, de boissons aromatisées, de protéines prédigentes et même de chewing-gommes.

