Propriétés du nitrile, nomenclature, utilisations, exemples

- 2222
- 620
- Anaïs Julien
Les Nitriles Ce sont tous ces composés organiques qui ont le groupe fonctionnel CN, qui est également appelé groupe cyano, ou cyanure en termes de chimie inorganique. Les nitrouls aliphatiques sont représentés avec la formule générale RCN, tandis que les nitriles aromatiques avec la formule Arcn.
Bien que le cyanure d'hydrogène, le HCN et ainsi que les sels métalliques de cyanure soient des composés hautement toxiques, exactement le même ne se produit pas avec les nitriles. Le groupe CN dans un squelette de carbone de toute sorte (ramifié, linéaire, aromatique, etc.), il se comporte en diagonale différent d'un anion cyanure, cn-.
 Formule générale pour un nitrile aliphatique. Source: Benjah-Bmm27 via Wikipedia.
Formule générale pour un nitrile aliphatique. Source: Benjah-Bmm27 via Wikipedia. Les nitriles sont très disséminés dans le monde des plastiques, car plusieurs d'entre eux dérivent de l'acrillonitrile, ch2CHCN, un nitrile avec lequel les polymères sont synthétisés comme les caoutchoucs de nitrile, utilisés pour faire une chirurgie ou des gants de laboratoire. Les nitriles sont également présents dans de nombreux produits naturels et pharmaceutiques.
D'un autre côté, les nitriles sont des précurseurs d'acides carboxyliques, car leur hydrolyse représente une méthode alternative de synthèse pour obtenir ce dernier.
[TOC]
Caractéristiques et propriétés
Structure
Les structures moléculaires des nitriles varient en fonction de l'identité de R ou AR dans les composés RCN ou ARCN, respectivement.
Cependant, la géométrie du groupe CN est linéaire en raison de son triple lien, C≡N, qui est le produit de l'hybridation SP. Ainsi, les atomes C-C≡N sont situés dans la même ligne. Au-delà de ces atomes, il peut y avoir une structure.
Polarité
Les nitriles sont des composés polaires, car l'azote du groupe CN est très électronégatif et attire des électrons vers lui-même. Par conséquent, ils ont des points de fusion ou d'ébullition supérieurs à leurs homologues pour.
Il peut vous servir: Scandio: Historique, propriétés, réactions, risques et utilisationsPar exemple, acétonitrile, cho3CN, c'est un liquide qui bout à 82 ºC; Tandis que Etano, ch3Ch3, C'est un gaz qui bouillonne à -89 ºC. Notez le grand effet que le groupe CN a sur les interactions intermoléculaires.
Le même raisonnement s'applique à des composés plus élevés: s'ils ont un ou plusieurs groupes CN dans leur structure, il est très probable que leur polarité augmentera et sera plus liée aux surfaces ou aux liquides polaires.
Basicité
On pourrait penser qu'en raison de la forte polarité des nitriles, ce sont des bases relativement fortes devant les amines. Cependant, nous devons considérer les liaisons covalentes C≡N et le fait que le carbone et l'hydrogène ont une hybridation SP.
La basicité de la RCN: elle est représentée en acceptant un proton de l'eau: eau:
RCN: + H2Ou ⇌ rcnh+ + Oh-
Pour protone le RCN: le couple sans électrons sur l'azote doit former un lien avec l'ion h+. Mais il y a un inconvénient: l'hybridation de l'azote le rend trop électronégatif, à tel point que cette paire d'électrons est très fortement attirée et ne permet même pas à une liaison de se former.
Par conséquent, on dit que la paire d'azote d'azote d'azote n'est pas disponible et que la basicité des nitriles est très faible. En fait, les nitriles sont des millions de fois moins basiques que les amines.
Réactivité
Parmi les réactions les plus représentatives de nitriles, nous avons leur hydrolyse et leur réduction. Ces hydrolyse sont médiées par l'acidité ou la basicité de l'environnement aqueux, provoquant un acide carboxylique ou un sel de carboxylate, respectivement:
Peut vous servir: équilibre de vapeur liquideRCN + 2H2O + HCL → RCOOH + NH4CL
RCN + H2O + NaOH → RCONA + NH3
Dans le processus, un amida est également formé.
Les nitriles sont réduits en amines à l'aide de catalyseurs d'hydrogène et de métal:
RCN → RCH2NH2
Nomenclature
Selon la nomenclature de l'IUPAC, les nitrilles sont nommées en ajoutant le suffixe-nitrile au nom de la chaîne alcane dont il dérive, comprenant également le carbone du cyano. Ainsi, Cho3CN s'appelle Ethanonitrilo et Cho3Ch2Ch2CN, butanonitrile.
Ils peuvent également être nommés à partir du nom de l'acide carboxylique, qui est éliminé par le mot «acide», et les suffixes sont remplacés -oic ou -oico par le suffixe -onitrile. Par exemple, pour ch3Le CN serait de l'acétonitrile (acide acétique); Pour c6H5CN, ce serait le benzonitrile (d'acide benzoïque); Et pour lui (Cho3)2CHCN, 2-méthylpropanitrile.
Alternativement, si les noms des substituants alquiliciens sont pris en compte, les nitriles peuvent être mentionnés en utilisant le mot «cyanure». Par exemple, Cho3CN serait alors appelé le cyanure de méthyle et (CHO3)2CHCN, cyanure d'isopropyle.
Applications
Les nitriles font partie des produits naturels, étant dans des amandes amères, dans les os de divers fruits, chez les animaux marins, les plantes et les bactéries.
Ses groupes CN constituent les structures des lipides cyanogéniques et des glycosides, des biomolécules qui, lorsqu'ils libèrent dégradés, libèrent du cyanure d'hydrogène, HCN, un gaz très toxique. Par conséquent, ils ont une utilisation biologique imminente pour certaines créatures.
Il a été déjà dit que les groupes CN offrent beaucoup de polarité aux molécules, et en fait, ils ne passent pas inaperçus lorsqu'ils sont présents dans des composés ayant une activité pharmacologique. De tels médicaments en nitrile ont été utilisés pour lutter contre l'hyperglycémie, le cancer du sein, le diabète, la psychose, la dépression et d'autres troubles.
Peut vous servir: réaction irréversible: caractéristiques et exemplesEn plus d'avoir un rôle dans la biologie et la médecine, ils constituent une poignée de plastiques en nitrile, avec lesquels des gants chirurgicaux et de laboratoire sont fabriqués, des timbres de parties automobiles, de tuyaux et d'articulations en raison de leur résistance contre la corrosion et les graisses, des matériaux tels que Tupperware, instruments de musique ou blocs legos.
Exemples de nitrile
Suivant et enfin quelques exemples de nitriles seront répertoriés.
Caoutchoucs en nitrile
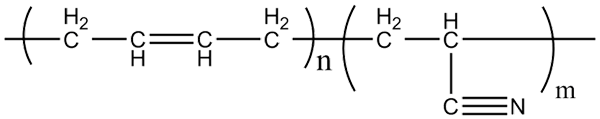 Structure moléculaire des copolymères acrilonitrile-butadiène. Source: Klever via Wikipedia.
Structure moléculaire des copolymères acrilonitrile-butadiène. Source: Klever via Wikipedia. Le caoutchouc de nitrile, avec lequel les gants susmentionnés et les matériaux résistants aux graisses sont fabriqués, est un copolymère formé par l'acrilonitrile et le butadiène (ci-dessus). Notez à quoi ressemble le groupe CN linéaire.
Ciammazine
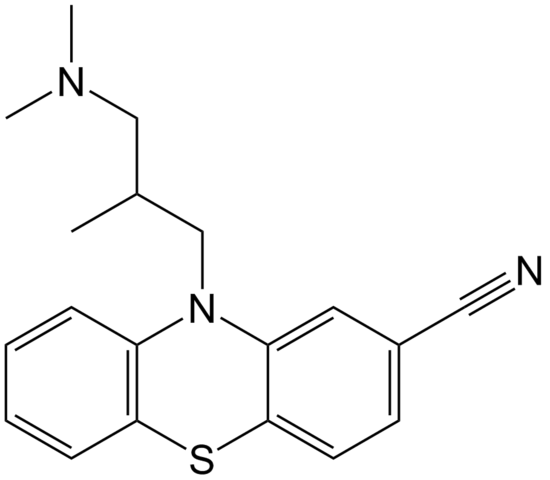 Structure moléculaire de la cipémazine. Source: Domaine EPOP / Pub
Structure moléculaire de la cipémazine. Source: Domaine EPOP / Pub La cyammazine est un exemple de nitrile dans la zone de pharmacie qui est utilisée comme antipsychotique, spécifiquement pour traiter les troubles de l'anxiété et de la schizophrénie. Encore une fois, notez la linéarité du groupe CN.
Citalopram
 Un autre médicament en nitrile est le citalopram, utilisé comme antidépresseur
Un autre médicament en nitrile est le citalopram, utilisé comme antidépresseur Amygdalin
 Structure moléculaire de la tonsiline. Source: Wesalius / Domaine public
Structure moléculaire de la tonsiline. Source: Wesalius / Domaine public L'amygdale est un exemple de glucó cyanogénique. Il se trouve dans les amandes amères, les prunes, les abricots et les pêches. Notez à quel point le groupe CN est petit concernant le reste de la structure; Malgré cela, sa présence unique est suffisante pour fournir une identité chimique unique à ce glucides.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Nitrile. Récupéré de: dans.Wikipédia.org
- CHIMISTER BOOLISTexts. (5 juin 2019). Chimie des nitriles. Récupéré de: Chem.Bibliothèque.org
- Jim Clark. (2016). Hydrolysing nitriles. Récupéré de: Chemguide.co.ROYAUME-UNI
- Ivy rose holistique. (2020). Nitrile dénomination. Récupéré de: ivyrose.com
- Germán Fernández. (s.F.). Nomenclature de nitrile: règles IUPAC. Récupéré de: Chemicicaorganica.org
- « Les 8 principaux courants psychologiques et leurs auteurs
- Structure de la métilamine, propriétés, production, utilisations »

