Structure de la métilamine, propriétés, production, utilisations
- 3253
- 756
- Prof Noah Collet
La Métilamine C'est un composé organique dont la formule condensée est Cho3NH2. Plus précisément, il s'agit de l'alkyamine primaire la plus simple de toutes, car elle ne contient qu'un substituant alquilique, ce qui est la même chose que de dire qu'il n'y a qu'un seul lien covalent C-N.
Dans des conditions normales, c'est un gaz d'ammoniac qui sent le poisson, mais c'est relativement facile à condenser et à transporter dans les réservoirs hermétiques. De même, il peut être dissous sensiblement dans l'eau, provoquant des solutions jaunâtres. D'un autre côté, il peut également être transporté comme solide sous la forme de votre sel de chlorhydrate, ch3NH2· HCL.
 Motilamine molécule. Source: Benjah-Bmm27 via Wikipedia.
Motilamine molécule. Source: Benjah-Bmm27 via Wikipedia. La métilamine se produit industriellement à partir d'ammoniac et de méthanol, bien qu'il existe de nombreuses autres méthodes de production à des échelles de laboratoire. Son gaz est très explosif, donc toute source de chaleur proche a le potentiel de provoquer un grand feu.
C'est un composé à forte demande commerciale, mais en même temps, il présente de fortes restrictions juridiques car elle sert de matière première pour la drogue et les substances psychotropes.
[TOC]
Structure
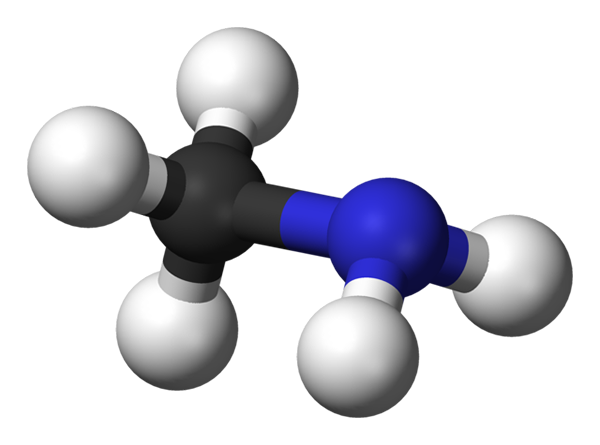
L'image ci-dessus montre la structure moléculaire de la méthylamine représentée par un modèle de sphères et de barres. La sphère noire correspond à l'atome de carbone, au bleu de l'atome d'azote et au blanc aux atomes d'hydrogène. C'est donc une petite molécule, où le méthane, le cho4, Perdre un H pour un groupe NH2, donnant ch3NH2.
La métilamine est une molécule hautement polaire, car l'atome d'azote attire la densité de carbone électronique et les atomes d'hydrogène. Il a la capacité de former également des ponts d'hydrogène entre le recueil de ses forces intermoléculaires. Chaque molécule de ch3NH2 Vous pouvez donner ou accepter un pont d'hydrogène consécutif (CH3Hnh-nh2Ch3).
Peut vous servir: qu'est-ce que la théorie du groupe?Cependant, sa masse moléculaire est considérablement faible, en plus des ports ch3 Ils entravent de tels ponts d'hydrogène. Le résultat est que la méthylamine est un gaz dans des conditions normales, mais cela peut être condensé à une température de -6 ºC. Lorsque vous cristallisez, il le fait après une structure ortorrombique.
Propriétés
Apparence physique
Gaz coloré ou liquide, mais dont les solutions aqueuses peuvent présenter des tons jaunâtres.
Odeur
Désagréable, similaire à celui d'un mélange de poissons et d'ammoniac.
Masse molaire
31 058 g / mol
Point de fusion
-93.10 ºC
Point d'ébullition
Autour du -6 ºC. Par conséquent, c'est un gaz qui peut se condenser à des températures pas trop froides.
Densité
656,2 kg / m3 à 25 ºC. Ses vapeurs sont denses de 1,1 fois que l'air, tandis que son liquide ou son condensat est environ 0,89 fois moins dense que l'eau.
La pression de vapeur
À température ambiante, la pression de votre vapeur varie 3,5 atm.
Moment dipolaire
1,31 D
Solubilité dans l'eau
1.080 g / L à 20 ºC. C'est un gaz qui se dissout très bien dans l'eau, car les deux molécules sont polaires et liées les unes aux autres lors de l'établissement de ponts d'hydrogène (CH3HNH-OH2).
Basicité
La métilamine a une constante de basicité (PKb) de 3.36. Cette valeur indique qu'il s'agit d'une substance considérablement basique, encore plus que le même ammoniac, de sorte qu'il s'est dissous dans l'eau libère une certaine quantité d'ions OH- Lorsqu'il est hydrolysé:
Ch3NH2 + H2Ou ⇌ ch3NH3+ + Oh-
La métilamine est plus fondamentale que l'ammoniac car son atome d'azote a une plus grande densité électronique. C'est parce que Cho3 Fait plus d'électrons d'azote que les trois atomes d'hydrogène dans la molécule NH3. Malgré cela, la méthyilamine est considérée comme une base faible devant d'autres alkyamines ou amines.
Peut vous servir: Type de lien CO2point de rupture
-10 ºC à une tasse fermée, ce qui signifie qu'il s'agit d'un gaz très inflammable et dangereux.
Température d'auto-direction
430 ºC
Tension superficielle
19,15 Mn / m A 25 ºC
Décomposition
Lors de la combustion, il est décomposé thermiquement dans des oxydes de carbone et d'azote, qui forment une fumée toxique.
Production
La métilamine peut être produite ou synthétisée soit par la méthode commerciale ou industrielle, soit par des méthodes de laboratoire à des échelles inférieures.
Industriel
La métilamine se produit industriellement à travers la réaction qui se déroule entre l'ammoniac et le méthanol sur un soutien au gel sympathique catalytique. L'équation chimique de cette réaction est la suivante:
Ch3OH + NH3 → CH3NH2 + H2SOIT
Dans le processus, d'autres alkamins peuvent être générés; Cependant, la méthyilamine est le produit qui semble cinétiquement plus favorisé.
Laboratoire
Au niveau du laboratoire, il existe plusieurs méthodes qui permettent de synthétiser la méthylamine à petite échelle. L'un d'eux est la réaction dans un fort milieu de base, de KOH, entre l'acétamide et le brome, pendant lequel l'isocian du méthyle est généré, ch3NCO, qui à son tour est hydrolysé pour devenir méthylation.
La métilamine peut être stockée sous forme de solide si cela est neutralisée avec de l'acide chlorhydrique, de sorte qu'un sel de chlorhydrate se forme:
Ch3NH2 + HCL → CH3NH2· HCL
Ensuite, chlorhydrate de méthylamine, également représenté comme [ch3NH3] CL, peut être basé sur un endroit sûr pour obtenir la solution aqueuse avec du gaz dissous:
[Ch3NH3] Cl + NaOH → Ch3NH2 + NaCl + H2SOIT
D'un autre côté, la méthylamine peut également être synthétisée à partir de l'hexamine (CH2)6N4, qui est directement hydrolysé avec de l'acide chlorhydrique:
Peut vous servir: cristallisation(Ch2)6N4 + HCl + 6 h2O → 4 NH4Cl + 6 CH2SOIT
Consécutivement, le chlorure d'ammonium réagit avec le formaldéhyde chaud pour provoquer des vapeurs de méthyilamine et d'acide formique, HCOOH.
De plus, la méthylamine peut être obtenue en réduisant le nitrométhane, ch3NON2 avec du zinc métallique et de l'acide chlorhydrique.
Applications
 L'éphédrine est un médicament qui a besoin de méthyilamine pour la production commerciale. Source: Turquie.
L'éphédrine est un médicament qui a besoin de méthyilamine pour la production commerciale. Source: Turquie. La métilamine est un composé dont les utilisations génèrent généralement une controverse, car c'est une substance utilisée dans la synthèse des stupéfiants tels que la méthamphétamine. En fait, sa popularité est due au désir que les protagonistes de la série télévisée Breaking Bad ont dû l'obtenir à tout prix.
Ce composé est également utilisé comme matière première pour la production d'insecticides, de médicaments, de tensioactifs, d'explosifs, de colorants, de fongicides, d'additifs, etc., Il a donc une forte demande mondiale, en plus de multiples restrictions juridiques pour son acquisition.
Son immense polyvalence chimique est due à sa molécule CHO3NH2 C'est un bon agent nucléophile, lié ou coordonné aux substrats d'une plus grande masse moléculaire dans plusieurs réactions organiques. Par exemple, cela est basé sur la synthèse de l'éphédrine, où Cho3NH2 Il rejoint une molécule avec la perte conséquente d'un H.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Méthylamine. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Méthylamine. Base de données PubChem., CID = 6329. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Dylan Matthews. (15 août 2013). Voici ce que «Breaking Bad» va bien et mal sur l'entreprise de méthamphétamine. Récupéré de: WashingtonPost.com
- Préparer. (2020). Préparation du chlorhydrate de méthylamine. Récupéré de: prepchem.com
- « Propriétés du nitrile, nomenclature, utilisations, exemples
- Organisation politique des Aztèques du pouvoir »

