Propriétés des nitrates, structure, nomenclature, formation
- 4607
- 902
- Mlle Ambre Dumont
Les Nitrates Ce sont tous ces composés qui contiennent des anions3-, En ce qui concerne les sels inorganiques, ou le groupe nitro, -ono2, Dans le cas des dérivés organiques. Dans inorganique, tous les nitrates sont des sels métalliques ou des ions d'ammonium, dans lesquels les interactions électrostatiques m prédominentn+NON3-.
Par exemple, nitrate de sodium3, Il est formé par des ions na+ et non3-. Ce sel, avec le nitrate de potassium, kno3, sont les spécimens les plus abondants dans la nature. Les nitrates trouvent dans les sols, dans les tissus végétaux et surtout dans les mers et les dépôts salins tels que le salitre, situé au Chili.
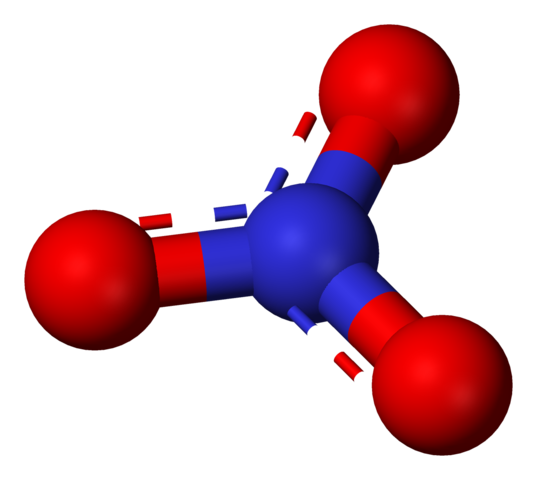
 Anion nitrate représenté par un modèle de sphères et de barres. Source: Benjah-Bmm27 / Domaine public.
Anion nitrate représenté par un modèle de sphères et de barres. Source: Benjah-Bmm27 / Domaine public. Le terme «nitrates» fait immédiatement allusion aux sels, aux engrais et aux explosifs. Ils sont également liés aux viandes et à leurs processus de durcissement pour inhiber la croissance des bactéries et ainsi retarder leur détérioration. Les nitrates sont également des synonymes pour les légumes, car ils contiennent des quantités élevées de ces sels.
Lui non3- (Image supérieure) est la forme la plus oxydée d'azote, étant le produit final et assimilable de son cycle biologique. L'azote de l'atmosphère souffre de plusieurs transformations, soit par le travail des rayons électriques, soit par des actions microbiennes, pour devenir NH4+ et non3-, Les deux solubles dans l'eau et absorbables par les plantes.
Les nitrates sont utilisés comme agents oxydants, engrais, explosifs et médicaments cardiologiques. Cette dernière utilisation contraste beaucoup avec les autres, car ils métabolisent ou interagissent avec le corps de telle manière qu'ils dilatent les veines et les artères; Et par conséquent, il y a une augmentation et une amélioration de la circulation sanguine, soulager les douleurs cardiaques.
[TOC]
Propriétés des nitrates
Neutralité
Les nitrates sont en principe des substances neutres, comme non3- C'est la base conjuguée de l'acide nitrique, HNO3, Un acide fort. Dans l'eau, ce n'est pas appréciable:
NON3- + H2Ou ⇌ hno3 + Oh-
En fait, on peut dire que cette hydrolyse ne se produit pas du tout, les quantités d'Oh étant méprisables-. Par conséquent, les solutions aqueuses de nitrate sont neutres à moins qu'il y ait d'autres substances dissoutes.
Apparences physiques
Les nitrates inorganiques sont constitués de sels dont les formules générales sont m (non3)n, être n C'est la valence ou la charge positive du cation métallique. Tous ces nitrates ont une luminosité cristalline et ont des couleurs blanchâtres. Cependant, les nitrates de métaux de transition peuvent être colorés.
Par exemple, nitrate de cuivre (II) ou nitrate de cuprique, Cu (non3)2, C'est un solide cristallin bleuâtre. Pendant ce temps, le nitrate de nickel (II), ni (non3)2, C'est une couleur émeraude solide. Quelques autres nitrates, comme le fer, présentent des couleurs faibles.
D'un autre côté, les nitrates organiques sont généralement des solides ou des solides très sensibles et explosifs.
Il peut vous servir: la matière vivante: concept, caractéristiques et exemplesDécomposition thermique
Les nitrates métalliques sont sensibles aux températures élevées, car elles commencent à se décomposer en fonction de l'équation chimique suivante:
2m (non3)2(s) → 2mo (s) + 4no2(g) + ou2(g)
Comme observé, le nitrate métallique se décompose en oxyde, MO et dioxyde d'azote et d'oxygène. Cette décomposition thermique ne se produit pas à la même température pour tous les nitrates; Certains résistent plus que d'autres.
En règle générale, plus la charge de cation m est plus grande et petite+, sera la plus grande température à laquelle le nitrate doit être chauffé pour se décomposer. Au lieu de cela, quand m+ Il est petit ou a une grande charge positive, le nitrate se décompose à des températures plus basses, donc plus instable.
Par exemple, nitrate de sodium3, Il se décompose à une température inférieure à celle du nitrate de baryum, BA (non3)2, Eh bien, bien que le BA2+ avoir une charge plus grande que Na+, Sa taille est beaucoup plus grande.
Agent d'oxydation
Lui non3- C'est un anion relativement stable. Cependant, son atome d'azote est fortement oxydé, avec un état d'oxydation de +5 (n5+SOIT32-), Il est donc "assoiffé" d'électrons. Pour cette raison, le nitrate est un agent oxydant, qui cherchera à arracher des substances électrons autour.
C'est ce manque d'électrons dans l'atome d'azote de non3- Ce que fait le nano3 Et Kno3 Agents oxydants puissants, utilisés comme composants de poudre à canon. Ajoutant à cette caractéristique le fait que les gaz sont libérés2 je2 En décomposition, il est compris pourquoi il fait partie de nombreux explosifs.
Lorsque le nitrate gagne des électrons ou réduit, il peut être transformé en ammoniac, NH3, ou en oxyde nitrique, non, selon les réactifs et les conditions.
Solubilité
Tous les nitrates inorganiques, ou ce qui est le même, les nitrates en métal et en ammonium, NH4NON3, Ce sont des composés solubles dans l'eau. C'est parce que les molécules d'eau ont une forte affinité pour ne pas3-, Et que les réseaux cristallins de ces nitrates ne sont pas très stables.
Structure
Anion nitrate
 Structures de résonance nitrate. Source: Benjah-Bmm27 / Domaine public.
Structures de résonance nitrate. Source: Benjah-Bmm27 / Domaine public. L'image supérieure montre les structures de résonance de l'anion nitrate. Comme on peut le voir, deux charges négatives sont situées dans deux atomes d'oxygène, qui sont démocalisés entre les trois atomes d'oxygène. Par conséquent, chacun ou a une charge de -2/3, tandis que l'azote a une charge de +1.
Alors, le non3- Interaction électrostatiquement, ou former des liens de coordination, à travers l'un de ses trois atomes d'oxygène.
Solides
Tous les nitrates inorganiques sont salins et ioniques. Par conséquent, ses structures sont cristallines, ce qui signifie que ses ions, m+ et non3-, Ils sont disposés dans l'espace grâce à leurs interactions électrostatiques. Selon ces interactions, leurs cristaux présenteront différentes structures.
Peut vous servir: quel est le losange de sécurité et à quoi sert?Par exemple, la structure cristalline de Nano3 C'est trigonal ou rhomboédica, tandis que celui du kno3 C'est ortorrombique.
Nitrates biologiques
Les nitrates organiques sont représentés avec la formule générale Rono2, où r est un groupe alkyle ou aromatique. Ces composés sont caractérisés par leur lien R-AON2, et se composent généralement de dérivés nitriques de polymères et d'autres substances organiques.
Complexe
Lui non3- Il se coordonne avec des centres métalliques pour former un lien m+-OU NON2-, Être une interaction différente de l'ionic. Ces complexes sont essentiellement des natures inorganiques. Le nitrate peut même être coordonné en utilisant deux de ses atomes d'oxygène en même temps, M+-SOIT2NON.
Nomenclature
Pour nommer un nitrate, les mots «nitrate de» suivis du nom du cation ou du groupe qui l'accompagne dans leur formule chimique respective doivent être écrits en premier. Le valence du cation est spécifié entre parenthèses lorsqu'il possède plus d'un. De même, les suffixes peuvent être utilisés -co et -oy si c'est le cas, suivant la nomenclature traditionnelle.
Par exemple, considérez la foi (non3)3. Son nom est le nitrate de fer (III), car sa valence est +3, ou peut également être appelée nitrate ferrique.
Ces règles s'appliquent également aux nitrates organiques, à condition que leurs structures soient simples. Par exemple, Cho3OU NON2 Il est appelé méthyl nitrate, car le groupe -ch3 Il devient le groupe R qui accompagne -ono2.
Entraînement
Naturel
Les nitrates sont formés dans la nature dans le cadre du cycle biologique de l'azote. Pour cette raison, les sols, les mers et certains courants d'eau ont des quantités importantes de nitrates. Selon les ions environnants, différents sels de nitrates seront formés, étant nano3 Et Kno3 Le plus commun et le plus abondant.
Industriel
Les nitrates sont formés à des échelles industrielles par neutralisation de l'acide nitrique, soit avec des hydroxydes métalliques, des alcools, des polymères, etc. Par exemple, nitrate de calcium, CA (non3)2, Il peut être préparé en fonction de l'équation chimique suivante:
Ca (oh)2 + 2hno3 → CA (non3)2 + 2h2SOIT
De même, plusieurs substances organiques sont attaquées par HNO3 dans certaines conditions pour promouvoir le remplacement de certains de leurs groupes par -ono2. C'est ce qui se passe avec la réaction de la cellulose pour se transformer en nitrocellulose ou nitrate de cellulose, un matériau polymère et explosif.
Photocatalytique
L'anion non3-, Et donc les nitrates inorganiques peuvent être formés par l'action photocatalytique des déchets d'oxyde de titane, oncle2, en utilisant comme matière première rien de plus que de l'azote et de l'oxygène d'air. Cette étude suppose que là où il y a des excès de gars2, il y aura des quantités indésirables de non3-, qui affectent la potabilité de l'eau et peuvent inclure des algues.
Peut vous servir: aldéhydosApplications
Durcissement de la viande
 Les saucisses sont l'une des viandes transformées qui contiennent plus de nitrates. Source: pxhere.
Les saucisses sont l'une des viandes transformées qui contiennent plus de nitrates. Source: pxhere. Les nitrates sont ajoutés à plusieurs viandes, en particulier les saucisses, pour éliminer les bactéries et ainsi retarder leur détérioration. Ils réagissent également avec leurs protéines pour leur donner une couleur plus rougeâtre. Le problème de ces viandes est qu'en les faisant cuire à des températures élevées, ils produisent des nitrosoamines: composés liés au cancer du côlon.
Cette réaction est en partie évitée s'il y a des vitamines présents, comme c'est le cas avec les légumes, qui, bien qu'ils soient riches en nitrates, ne sont pas associés à des pathologies cancérigènes.
Agriculture
Les nitrates sont une source d'azote soluble. Par conséquent, il sert d'engrais à contribuer à l'azote aux plantes, et donc favoriser leur croissance.
Médecine
Les nitrates ont une fonction spéciale dans le corps. Lors de l'assimilation par action enzymatique, elle est réduite à l'oxyde nitrique, non. Cette molécule occupe le volume et dilate les veines et les artères, permettant qu'il y ait un plus grand flux sanguin. Par conséquent, les nitrates sont utilisés comme médicaments pour lutter contre les pathologies du système circulatoire.
Ironique et curieusement, à cet effet des nitrates organiques tels que le glycérilo, la nitroglycérine, le mononitrate isosorbide et le pentaerithritol tétranitrate ont été utilisés, tous les bons candidats dans le monde des explosifs.
Explosifs
Les nitrates sont utilisés dans des formulations explosives, la poudre à canon étant l'exemple le plus symbolique. Étant des agents oxydants, ils favorisent la combustion de la matière, en plus de contribuer à l'expansion brutale du volume en raison de leur libération de gaz après la décomposition.
Exemples de nitrates
Dans les sections précédentes, plus d'un exemple de nitrates a été mentionné. Enfin, certains autres seront répertoriés avec leurs formules et noms respectifs:
-Lin3: Nitrate de lithium
-RBNO3: Nitrate de rubidio
-Mg (non3)2: Nitrate de magnésium
-SC (non3)2: Nitrate de scandio
-CR (non3)3: Nitrate chromé (III)
-Zn (non3)2: nitrate de zinc
-PB (non3)2: nitrate de plomb (II)
-Agno3: nitrate d'argent
-Ch3Ch2OU NON2: Nitrate d'éthyle
-Ch3(Ch2)4OU NON2: Nitrate d'amilo
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Clark J. (5 juin 2019). La stabilité thermique des nitrates et des carbonates. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Wikipédia. (2020). Nitrate. Récupéré de: dans.Wikipédia.org
- Angela Dowden. (12 mars 2019). La vérité sur les nitrates dans votre nourriture. Récupéré de: BBC.com
- Elsevier B.V. (2020). Nitrate. ScienceDirect. Récupéré de: ScienceDirect.com
- Docteur. Biji s. & Prof. Govindan V. (26 avril 2017). Le rôle des nitrates organiques dans la gestion médicale optimale de l'angine. Société européenne de cardiologie. Récupéré de: Escardio.org
- Yuan, s., Chen, J., Lin, Z. et al. (2013). Formation de nitrate à partir d'azote atmosphérique et de photocatalysé par l'azote et de l'oxygène par du dioxyde de titane nano-sted. Nat Commun 4, 2249. est ce que je.org / 10.1038 / ncomms3249
- « Fondamentaux de la thérapie narrative de Michael White, procédure, techniques
- Nomenclature époxy, obtention, applications, exemples »

