Nomenclature époxy, obtention, applications, exemples
- 2472
- 617
- Mlle Ambre Dumont
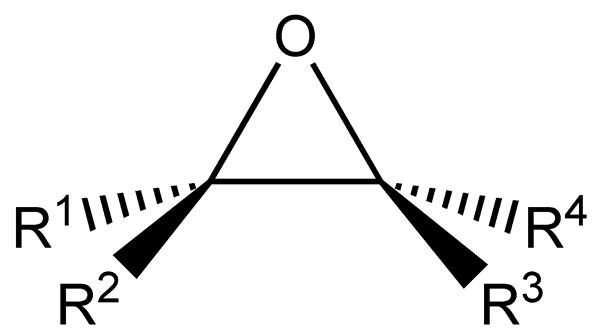
Les Époxydes Ce sont des hydrocarbures aliphatiques ou cycliques qui ont un atome d'oxygène lié en même temps à deux atomes de carbone dans leur structure. Ce lien, comme on le voit dans l'image inférieure, présente une géométrie triangulaire, assez caractéristique pour tous les époxydes.
Les époxydes proviennent d'alcènes qui souffrent de la rupture d'une double liaison pour former le groupe fonctionnel de l'époxyde. Chacun des deux atomes liés à l'oxygène est également lié aux groupes latéraux R1, R2, R3 et r4, toutes les parties de la même molécule.
 Formule structurelle et générale pour les époxydes. Source: Tomas Kindahl / Domaine public.
Formule structurelle et générale pour les époxydes. Source: Tomas Kindahl / Domaine public. Le groupe fonctionnel de l'époxyde est caractérisé par une grande tension, ce qui confère une réactivité plus grande que celle d'un éther non cyclique. Les réactions d'époxyde s'accompagnent généralement de la rupture de leur groupe fonctionnel.
L'époxyde le plus simple correspond à l'époxyde d'éthane, également appelé oxyde d'éthylène, oxyde d'éthylène ou oxirano. De tous, c'est l'époxyde d'une plus grande importance commerciale.
La plus grande proportion de production d'époxyde est destinée à la peinture (revêtements de surface). Ils sont également utilisés dans la production de tensioactifs, d'adhésifs, de plastifiants, etc.
[TOC]
Nomenclature
Les composés avec le groupe fonctionnel d'époxyde peuvent être appelés de différentes manières, tels que: époxy, époxydes ou autres noms sans aucune connotation systématique, comme: oxirano.
Les époxydes avec des structures chimiques plus simples sont généralement nommés d'oxydes. De cette façon, l'époxyde de propeno (C3H6) Il est appelé propeno oxyde (c3H6SOIT).
Il est courant d'être appelé époxyde identifiant les carbones qui sont présents dans le groupe fonctionnel de l'époxyde. Par exemple: 2,3-époxyhexan, 1,2-époxychiclohexan et 1,2-époxipropane. C'est-à-dire que le "triangle" se trouve dans les carbones 2 et 3 de l'hexane, et ainsi de suite avec le cyclohexan et le propane.
Peut vous servir: enthalpieObtention
Oxydation catalytique
L'époxyde d'oxyde d'ethno ou d'éthylène est préparé par l'oxydation catalytique de l'éthylène dans l'air chaud ou l'oxygène, utilisé comme catalyseur en argent métallique:
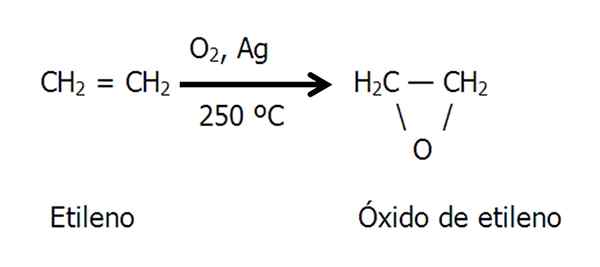 Équation de la synthèse d'oxyde d'éthylène. Source: Gabriel Bolívar.
Équation de la synthèse d'oxyde d'éthylène. Source: Gabriel Bolívar. Méthode de la chlorhydrine
Cette méthode est réalisée en deux étapes: a) formation de chlorhydrine, et b) traitement de la chlorhydrine avec une base pour éliminer l'acide chlorhydrique.
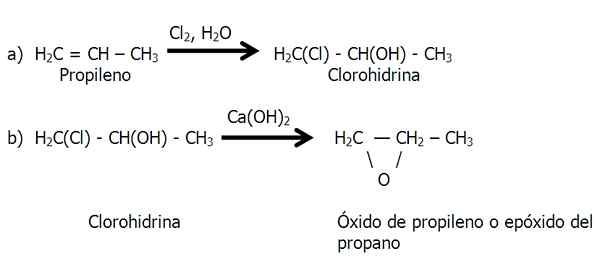 Étapes de la méthode de la chlorohydrine pour la synthèse de l'époxyde. Source: Gabriel Bolívar.
Étapes de la méthode de la chlorohydrine pour la synthèse de l'époxyde. Source: Gabriel Bolívar. Au stade b) une molécule HCL est perdue, dont l'hydrogène provient du groupe OH.
Peroxydation du carbone à double liaison
Les époxydes peuvent également être formés par la peroxydation des alcènes, c'est-à-dire une oxydation causée par un voyou, comme l'acide peroxibenzoïque:
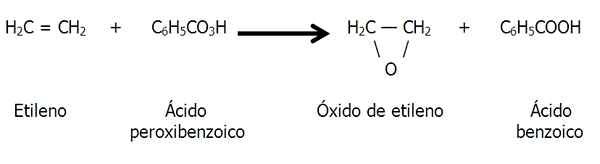 Peroxydation de l'éthylène pour former de l'oxyde d'éthylène ou de l'époxyde d'éthane. Source: Gabriel Bolívar.
Peroxydation de l'éthylène pour former de l'oxyde d'éthylène ou de l'époxyde d'éthane. Source: Gabriel Bolívar. Présence naturelle d'époxydes
Les époxydes sont de nature inhabituelle. Cependant, la synthèse hépatique des époxydes a été observée, médiée par le cytochrome P450. Les cellules produisent des époxydes comme produits d'oxydation des alcounos et des composés aromatiques.
Des composés tels que des épotylonas ont également été observés dans la nature, produits sous forme de métabolite secondaire des bactéries de Sorangium celosum.
Applications
Préparation des tensioactifs
L'oxyde d'éthylène est fréquemment utilisé dans la préparation de tensioactifs ou de surfactants, d'alcool ou de produits de réaction au phénol avec de l'oxyde d'éthylène. Les tensioactifs remplissent différentes fonctions, notamment: hydratants, détergents, émulsifiants et solubilisants.
Les hydratants augmentent l'hydratation de la surface en leur facilitant l'accès à l'eau. Les détergents éliminent la saleté des vêtements. Les émulsions permettent et stabilisent les émulsions. Et les solubilisants permettent la dissolution de quelques composés miscibles avec de l'eau.
Peut vous servir: loi fickAdhésifs et solvants
La réaction des époxydes, y compris l'oxyde d'éthylène, avec les amines est à la base de la préparation des files d'attente ou des gencives de pâte. Ces adhésifs sont utilisés pour produire l'union des surfaces, ainsi que dans la stabilisation du PVC.
L'oxyde d'éthylène réagit avec l'éthoxyde de sodium pour produire du 2-toxietanol, également connu sous le nom de celosolve. Ce composé chimique dissout les huiles, les résines, les graisses, les cires, la nitrocellulose et les lacas.
Résines époxydes
Les résines époxy ou époxy ont parmi leurs propriétés, une fois qu'ils ont été renforcés, une résistance chimique, thermique et mécanique élevée. Ces résistances permettent leur utilisation pour l'élaboration des lacs et des émaux, ainsi que pour le revêtement des métaux et des planchers de laboratoire et la fabrication de pièces électriques.
Certaines entreprises utilisent ces résines avec des charges de silice remplaçant la porcelaine pour fabriquer des isolateurs de ligne électrique. Les résines époxy sont également utilisées pour fabriquer des feuilles de circuits imprimés et des plaques renforcées de fibres de verre.
Les résines époxy ont quelques utilisations séparément, y compris la stabilité en vinyle. Pour augmenter leur utilité, ils sont liés au cross avec plusieurs composés dans un processus appelé "durci". Parmi les agents utilisés à cette fin, nous avons: primaire, secondaire, tertiaire et polyamides.
Les époxydes obtenus à partir d'huiles végétales sont utilisés pour la synthèse de la polio, utilisés dans l'industrie du polyuréthane.
Usages médicaux
Les épotylones sont des produits métaboliques des bactéries de Sorangium cellulosum, qui ont la propriété des microtubules stabilisants, produisant ainsi un blocage du cycle cellulaire.
L'utilisation d'ixabépilone, une épotylonas, a été approuvée pour le traitement du cancer du sein avancé. De même, l'utilisation de l'épotylone D a été étudiée dans le traitement de la maladie d'Alzheimer.
Peut vous servir: acide disulfurique: qu'est-ce que la structure, les propriétés, les utilisationsAutres utilisations
L'oxyde d'éthylène intervient dans la synthèse de l'éthylène glycol: composé utilisé comme antigel dans les systèmes de refroidissement des voitures. L'oxyde d'éthylène est également utilisé dans la stérilisation des matériaux médicaux et des instruments.
Toxicité
L'absorption par la peau, l'inhalation ou l'apport époxy sont associées à la production d'effets toxiques, à la fois chez l'homme et les animaux expérimentaux. Ceux-ci incluent: l'irritation des tissus de surface et la sensibilisation. Des altérations du fonctionnement du foie, des cellules sanguines et de la moelle osseuse sont également produites.
De même, les époxydes avec la cancérogénicité et la mutagénicité ont été liés à des époxydes. Les époroxydes, en raison de leur réactivité électrophylique élevée et de leur caractère de composés loués, ont été considérés comme des agents cancérigènes potentiels.
Exemples d'époxys
Enfin, quelques autres exemples d'époxys seront répertoriés:
-1,2-époxipropane
-2,3-époxyhexan
-1,2-époxyclohexan
-Extension de l'oxyde
-Oxyde isobutiléène
-3,4-epoxi-1-butno
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Époxyde. Récupéré de: dans.Wikipédia.org
- Leroy G. Patauger. (2020). Époxyde. Encyclopædia Britannica. Récupéré de: Britannica.com
- Manson M. M. (1980). Epoxydes: y a-t-il un problème de santé humaine? Journal britannique de médecine industrielle, 37(4), 317-336. est ce que je.org / 10.1136 / OEM.37.4.317
- Produits chimiques. (s.F.). Exemples d'époxys. Récupéré de: chimiques.filet
- W.g. Potier. (1963). La chimie et les utilisations des résines d'époxyde, Médecine du travail, volume 13, numéro 1, avril 1963, pages 42-47, doi.org / 10.1093 / occmmed / 13.1.42
- Molinero Muñoz, María et Fernández Arberas, Nerea. (2016). Épotylones, une alternative dans le domaine de l'antitumoral. Université de Madrid Complutense.
- Alejandro Aguirre F. & Lesly Espinoza B. (2018). Utilisations et applications des époxydes et des sulfures. Université centrale de l'Équateur. Récupéré de: Academy.Édu
- « Propriétés des nitrates, structure, nomenclature, formation
- Caractéristiques de réaction de Cannizzaro, mécanismes, exemples »

