Structure du nitrate de zinc, propriétés, obtenant, utilisation

- 1299
- 341
- Lucas Schneider
Il nitrate de zinc Il s'agit d'un composé inorganique formé par les éléments de zinc (Zn), d'azote (N) et d'oxygène (O) (O). L'état d'oxydation du zinc est +2, celui de l'azote est +5, et l'oxygène est -2.
Sa formule chimique est Zn (non3)2. C'est un cristallin incolore solide qui a tendance à absorber l'eau de l'environnement. Il peut être obtenu en traitant le métal de zinc avec de l'acide nitrique dilué. C'est un composé fortement oxydant.
 Nitrate de Zn Fifr (non3)2. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons.
Nitrate de Zn Fifr (non3)2. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons. Il sert d'accélérateur de réactions de chimie organique et vous permet d'obtenir des polymères composés aux propriétés de conduite en électricité. Il est utilisé pour former des couches de matériaux utiles en électronique.
Il fait partie de certains engrais liquides et de certains herbicides à libération lente. Aide à la préparation d'oxydes complexes améliorant votre densité et votre conductivité électrique.
Il a été testé avec succès dans l'obtention de structures qui servent de base à la régénération et à la croissance du tissu osseux, améliorant ce processus et entraînant un antibactérien.
Bien que ce ne soit pas du carburant, il peut accélérer la combustion de substances qui sont, comme le charbon ou les matières organiques. C'est une peau irritante, des yeux et des muqueuses, et est très toxique pour la vie aquatique.
[TOC]
Structure
Le nitrate de zinc est un composé ionique. Il a un cation bivalent (Zn2+) et deux anions monovalents (non3-). L'anion nitrate est un ion polyiatomique formé par un atome d'azote dans son état d'oxydation +5 attaché à trois atomes d'oxygène avec Valencia à partir de -2.
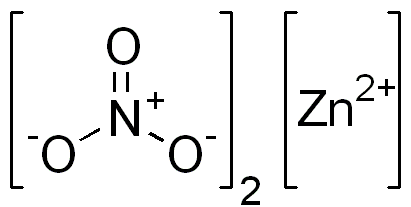 Structure de nitrate ionique du zinc. Domaine EDGAR181 / Pub. Source: Wikimedia Commons.
Structure de nitrate ionique du zinc. Domaine EDGAR181 / Pub. Source: Wikimedia Commons. L'image ci-dessous montre la structure spatiale de ce composé. La sphère centrale grise est le zinc, les sphères bleues sont l'azote et les sphères rouges représentent l'oxygène.
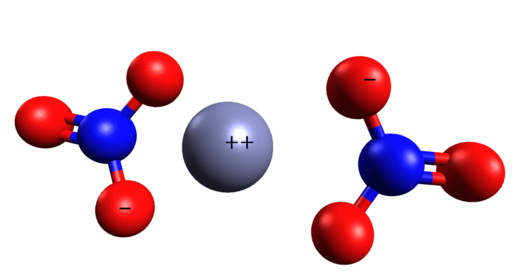 Structure spatiale de Zn (non3)2. CINC est au milieu des ions nitrates. Grasso Luigi / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Structure spatiale de Zn (non3)2. CINC est au milieu des ions nitrates. Grasso Luigi / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Nomenclature
- Nitrate de CINC
- Dinitrate de zinc
Propriétés
État physique
Solide incolore ou blanc cristallin.
Poids moléculaire
189,40 g / mol
Point de fusion
Environ 110 ºC.
Il peut vous servir: acide iarhydrique (HI): structure, propriétés et utilisationsPoint d'ébullition
Environ 125 ºC.
Densité
2 065 g / cm3
Solubilité
Eau soluble: 120 g / 100 g h2Ou à 25 ° C. Alcool soluble.
pH
Ses solutions aqueuses sont acides. Une solution de 5% a un pH d'environ 5.
Propriétés chimiques
Pour être un nitrate, ce composé est un fort oxydant. Réagit violemment avec le charbon, le cuivre, les sulfures métalliques, la matière organique, le phosphore et le soufre. S'il est pulvérisé sur des exploits de charbon chaud.
D'un autre côté, il est hygroscopique et absorbe l'eau de l'environnement. Si l'oxyde de zinc se forme, l'azote et le dioxyde d'oxygène:
2 Zn (non3)2 + Chauffer → 2 ZnO + 4 Non2↑ + o2↑
Dans les solutions alcalines, comme celles de NaOH, le zinc de ce composé forme son hydroxyde et d'autres espèces complexes:
Zn (non3)2 + 2 oh- → Zn (OH)2 + 2 Non3-
Zn (OH)2 + 2 oh- → [Zn (OH)4]]2-
Obtention
Il peut être obtenu en traitant du zinc ou de l'oxyde de zinc avec de l'acide nitrique dilué. L'hydrogène gazeux est formé dans cette réaction.
Zn + 2 Hno3 → Zn (non3)2 + H2↑
Applications
Réactions catalyse
Il est utilisé comme catalyseur pour obtenir d'autres composés chimiques tels que les résines et les polymères. C'est un catalyseur acide.
 Exemple de résine. Bugman chez anglais wikipedia / domaine public. Source: Wikimedia Commons.
Exemple de résine. Bugman chez anglais wikipedia / domaine public. Source: Wikimedia Commons.  Modèle de structure de polymère. Domaine Ilmari Karonen / pub. Source: Wikimedia Commons.
Modèle de structure de polymère. Domaine Ilmari Karonen / pub. Source: Wikimedia Commons. Un autre cas d'accélération des réactions est le système catalytique de Zn (non3)2/ COV2SOIT4, ce qui permet à l'oxydation des α-hydrolysters des stress α-zo avec une conversion de 99% même à la pression et à la température environnementales.
Dans les polymères composés
Les films de polyméthylmétacrylate et de Zn ont été développés (non3)2 avec des propriétés de conductivité électrique qui en font des candidats appropriés à utiliser dans des supercages et ordinateurs à grande vitesse.
Dans les ciments oxystants
Avec des solutions aqueuses de nitrate de zinc et de la poudre d'oxyde de zinc, les matériaux appartenant à la classe de ciments générés par une réaction acide-base sont obtenus.
Ceux-ci ont une résistance raisonnable pour se dissoudre dans les acides dilués et les alcalis, développant une compression de résistance à la compression par rapport à celle des autres ciment.
Cette propriété augmente lorsque le rapport ZnO / Zn est augmenté (non3)2, Et lorsque la concentration de Zn est téléchargée (non3)2 Dans la solution. Les ciments obtenus sont complètement amorphes, c'est-à-dire qu'ils n'ont pas de cristaux.
Peut vous servir: précipitations chimiques Avec du nitrate de zinc, des tests d'obtention de ciments ont été effectués. Auteur: Kobthanapong. Source: Pixabay.
Avec du nitrate de zinc, des tests d'obtention de ciments ont été effectués. Auteur: Kobthanapong. Source: Pixabay. Dans les revêtements et nanomatériaux d'oxyde de zinc
Le Zn (non3)2 Il est utilisé pour le dépôt électrolytique de couches très minces d'oxyde de zinc (ZnO) sur divers substrats. Les nanostructures de cet oxyde sont également préparées sur les surfaces.
 Nanoparticules d'oxyde de zinc. Certaines nanostructures ZnO peuvent être préparées avec Zn (non3)2. Verena Wilhelmi, Ute Fischer, Heike Weverardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht / CC par (https: // CreativeCommons.Org / licences / par / 2.5). Source: Wikimedia Commons.
Nanoparticules d'oxyde de zinc. Certaines nanostructures ZnO peuvent être préparées avec Zn (non3)2. Verena Wilhelmi, Ute Fischer, Heike Weverardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht / CC par (https: // CreativeCommons.Org / licences / par / 2.5). Source: Wikimedia Commons. ZnO est un matériau d'un grand intérêt en raison de la multitude d'applications dans le domaine de l'optoléctronique, il possède également des propriétés de semi-conducteur et est utilisé dans les capteurs et les transducteurs.
Dans les herbicides
Le nitrate de CINC a été utilisé avec certains composés organiques pour réduire la vitesse de libération de certains herbicides dans l'eau. La libération lente de ces produits leur permet d'être disponible pour des applications plus longues et moins sont requises.
Dans la fabrication d'anodes
Stimule le processus de frittage et améliore la densité de certains oxydes qui servent à fabriquer des anodes pour les piles à combustible. Le frittage obtient un matériau solide à travers le chauffage et la compression d'une poudre sans atteindre sa fusion.
 Dessiner comment deux grains de frittage se produisent. Le Zn (non3)2 Aide à l'exécution de ce processus sur certains oxydes complexes. Domaine CDang / pub. Source: Wikimedia Commons.
Dessiner comment deux grains de frittage se produisent. Le Zn (non3)2 Aide à l'exécution de ce processus sur certains oxydes complexes. Domaine CDang / pub. Source: Wikimedia Commons. Les matériaux dans lesquels les tests ont été effectués sont des oxydes complexes de strontium, d'iridium, de fer et de titane. La présence de FAL augmente considérablement la conductivité électrique de ces.
Autres applications
Il est utilisé pour obtenir des médicaments. Il agit comme un mordant dans l'application des encres et des colorants. Sert de coagulant en latex. C'est une source de zinc et d'azote dans les engrais liquides.
Utilisation potentielle dans l'ingénierie des tissus osseux
Ce composé a été utilisé comme additif dans l'élaboration de l'armure ou des cadres pour la régénération des fibres osseuses, car elle permet d'améliorer la résistance mécanique de ces structures.
Peut vous servir: Germanio: histoire, propriétés, structure, obtention, utilisationsIl a été observé que l'échafaudage qui contient cinq n'est pas toxique pour les cellules d'ostéoprogénitrices, soutient l'activité des ostéoblastes qui sont les cellules qui fabriquent des os et améliorent leur adhérence et leur prolifération.
Favorise la formation d'Apatita qui est le minéral qui forme les os et exerce également un effet antibactérien.
 Le Zn (non3)2 Cela pourrait être très utile pour la reconstruction de la matière osseuse chez les personnes qui ont subi des accidents. Mariano Coretti / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Le Zn (non3)2 Cela pourrait être très utile pour la reconstruction de la matière osseuse chez les personnes qui ont subi des accidents. Mariano Coretti / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Des risques
C'est un matériau présentant un risque potentiel de feu et d'explosion.
Il n'est pas du carburant mais accélère la combustion de matériaux combustibles. Si une grande quantité de ce composé est impliquée dans un incendie ou si le matériau combustible est finement divisé, une explosion peut se produire.
Lorsqu'ils sont soumis à une chaleur forte, des oxydes d'azote toxiques sont produits. Et si l'exposition est effectuée prolongée, elle peut exploser.
Il est irritant pour la peau, il peut causer de graves dommages aux yeux, l'irritation des voies respiratoires, elle est toxique en raison de l'ingestion et endommage le tube digestif.
Très toxique pour la vie aquatique avec des effets qui durent.
Les références
- Ju, et. et al. (2019). Nouvel effet de nitrate de zinc / oxalate de vanadyle pour l'oxydation catalytique sélective des esters alpha-hydroxy en alfa-céto esers avec de l'oxygène moléculaire: un in situ in situ. Molécules 2019, 24, 1281. MDPI a récupéré.com.
- Mohd s., S.N. et al. (2020). Formulation de libération contrôlée de nitrate d'hydroxyde de zinc intercalé avec du dodécylsulphe de sodium et des anions bispyribac: un nouveau nanocomposite d'herbicide pour la culture du paddy. Arabian Journal of Chemistry 13, 4513-4527 (2020). Récupéré de ScienceDirect.
- Mec, m.P. et al. (2019). Résistance mécanique enrichie et minéralisation osseuse d'échafaudage biomimétique électrofilé chargé d'huile ylang ylang et de nitrate de zinc pour l'ingénierie tissulaire osseuse. Polymers 2019, 11, 1323. MDPI a récupéré.com.
- Kim, k.Toi. et al. (2018). Effets du nitrate de zinc comme aide à frittage sur les caractéristiques électrochimiques de la SR0,92ET0,08L'oncle3-delta et M0,92ET0,08Toi0.6Foi0.4SOIT3-delta Ceramics International, 44 (4): 4262-4270 (2018). Récupéré de ScienceDirect.com.
- Prasad, B.ET. et al. (2012). Électrodéposition du revêtement ZnO à partir de Zn aqueux (non3)2 Baths: Effet de la concentration de Zn, du dépôt de température et du temps sur l'orientation. J Solid State Electochem 16, 3715-3722 (2012). Lien récupéré.Springer.com.
- Bahadur, h. et srivastava, à.K. (2007). Morphologies de films minces dérivés de sol-gel de ZnO en utilisant différents matériaux précurseurs et leurs nanostructures. Nanoscale Res Lett (2007) 2: 469-475. Lien récupéré.Springer.com.
- Nicholson, J.W. et Tibaldi, J.P. (1992). Formation et propriétés du ciment préparé à partir d'oxyde de zinc et de solutions aqueuses de nitrate de zinc. J Mater Sci 27, 2420-2422 (1992). Lien récupéré.Springer.com.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Maji, P. et al. (2015). Effet de Zn (non3)2 Remplissage sur la démillilité diélectrique et le module électrique du PMMA. Bull Mater Sci 38, 417-424 (2015). Lien récupéré.Springer.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Nitrate de zinc. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Byju's. (2020). Nitrate de zinc - Zn (NO3) 2. Récupéré de byjus.com.
- Éléments américains. Nitrate de zinc. Récupéré des Américains.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- « Structure du chlorure de zinc (ZNCL2), propriétés, obtention, utilisations
- Cas concrets de procédure éthique dans les institutions et les organisations »

