Structure du chlorure de zinc (ZNCL2), propriétés, obtention, utilisations

- 3801
- 62
- Prof Noah Collet
Il chlorure de zinc C'est un composé inorganique formé par l'élément de zinc ou de zinc (Zn) et de chlore (CL). Sa formule chimique est ZNCL2. Le CINC se trouve dans l'état d'oxydation +2 et le chlore a une valence de -1.
C'est un solide incolore ou blanc cristallin. Il est très soluble dans l'eau et l'absorbe facilement de l'environnement, qui peut être vu sur la figure du solide humidifié illustré ci-dessous.
 Chlorure de FIFCL2 solide quelque peu hydraté. Utilisateur: Walkerma / Domaine public. Source: Wikimedia Commons.
Chlorure de FIFCL2 solide quelque peu hydraté. Utilisateur: Walkerma / Domaine public. Source: Wikimedia Commons. Le zinc de ce composé est biologiquement très important pour les humains, les animaux et les plantes, car il intervient dans des fonctions de base telles que la synthèse des protéines et des graisses.
Pour cette raison2 Il est utilisé comme complément nutritionnel aux animaux et aux humains en cas de carence en zinc et comme micronutriment pour les plantes.
Il a des propriétés bactériostatiques et astringentes et est largement utilisé à ces fins en médecine humaine et vétérinaire. Élimine également les ravageurs tels que les champignons en plein air et est intermédiaire pour obtenir des pesticides.
Parmi ses multiples utilisations, il sert à traiter les fibres de cellulose et de laine dans divers processus, ainsi que pour les préparer à la couleur ou à l'impression. Retarder également la combustion du bois.
[TOC]
Structure
Le zncl2 C'est un composé ionique formé par le cation Zn2+ et deux anions chlorure cl- qui se lient à travers les forces électrostatiques.
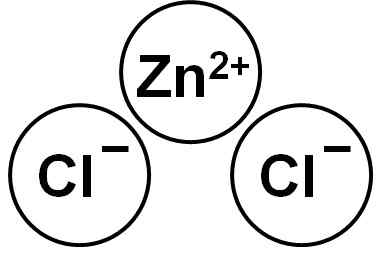 Chlorure de zinc. Auteur: Marilú Stea.
Chlorure de zinc. Auteur: Marilú Stea. L'ion zinc (ii) a la structure électronique suivante:
12, 2s2 2 P6, 3s2 3p6 3Ddix, 4s0,
dans lequel il est observé que les deux électrons du cap 4s, où la configuration est stable.
L'ion chlorure présente la structure suivante:
12, 2s2, 2 P6, 3s2 3p6,
qui est également très stable pour avoir des orbitales complètes.
Dans la figure, la façon dont les ions sont disponibles dans le verre peuvent être observés. Les sphères grises représentent le zinc et les sphères vertes au chlore.
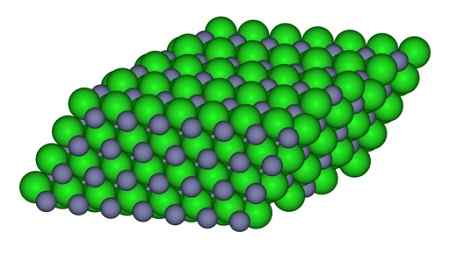 Structure qui forme les ions dans le cristal ZnCl2. CCOIL / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Structure qui forme les ions dans le cristal ZnCl2. CCOIL / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Nomenclature
- Chlorure de zinc (II)
- Dichlorure de zinc
Propriétés
État physique
Solide incolore ou blanc cristallin. Cristaux hexagonaux.
Poids moléculaire
136,3 g / mol
Point de fusion
290 ºC
Point d'ébullition
732 ºC
Densité
2 907 g / cm3 à 25 ° C
Solubilité
Très soluble dans l'eau: 432 g / 100 g h2Ou à 25 ° C, 614 g / 100 g de h2Ou 100 ° C. Très soluble dans l'acide chlorhydrique (HCl), l'alcool et le glycérol. Totalement miscible.
Peut vous servir: Hydroxyde de mercure: structure, propriétés, utilisations, risquespH
Ses solutions aqueuses sont acides. Une solution de 6 moles de zncl2/ L a un pH de 1,0.
Propriétés chimiques
C'est un composé hygroscopique et délicoscent, car en contact avec l'humidité de l'environnement, il absorbe beaucoup d'eau. Dans l'eau, il est hydrolysé et a tendance à former une base insoluble d'oxychlorure de zinc.
Réagit avec l'oxyde de zinc (ZnO) dans la génération d'oxychlorures de zinc qui constituent un matériau de ciment de type extrêmement dur.
Il est doucement corrosif envers les métaux.
Ce n'est pas inflammable.
Rôle biologique
Biologiquement le zinc est l'un des éléments les plus importants. Il a été reconnu comme essentiel pour tous les modes de vie.
Dans le corps humain, le ZNCL2 Zn fournit, ce qui est essentiel pour les protéines, le cholestérol et la synthèse des graisses. CINC en particulier est important pour le bon fonctionnement du système immunitaire.
 Le zinc zncl2 C'est important pour la division cellulaire dans les êtres vivants. Ladyofhats / domaine public. Source: Wikimedia Commons.
Le zinc zncl2 C'est important pour la division cellulaire dans les êtres vivants. Ladyofhats / domaine public. Source: Wikimedia Commons. Plus de 25 protéines contenant du zinc ont été identifiées, et beaucoup d'entre elles sont des enzymes, nécessaires en division et croissance cellulaire, et pour la libération de vitamine A du foie.
La carence en CINC peut entraîner une croissance de la croissance, une fonction mentale déprimée, une anorexie, une dermatite, une diminution de l'immunité, de la diarrhée et une mauvaise vision nocturne, entre autres conditions.
Obtention
Commercialement, ce composé est préparé en réagissant à l'acide chlorhydrique aqueux avec de la ferraille, des déchets de zinc ou avec le minéral qui le contient. Dans cette réaction, il y a aussi l'hydrogène gazeux (h2).
Le traitement du zinc avec du chlorure d'hydrogène à 700 ° C est obtenu.
Zn + HCl → Zncl2 + H2↑
Applications
Dans les traitements thérapeutiques
Il s'agit d'un antibactérien doux ou bactériostatique, il est donc utilisé dans les douches vaginales pour éliminer les tricomonas ou les infections à Haemophilus. Il sert également à traiter les callosités, en astringente et en chimiocirugie dans le cancer de la peau.
Il est utilisé comme astringent dans certains cosmétiques tels que des lotions rafraîchissantes pour la peau.
Comme complément nutritionnel
En raison de son importance dans diverses fonctions de l'organisme humain, le ZNCL2 Il est administré par voie orale dans le cadre des accessoires nutritionnels et également chez les personnes qui ont besoin d'aliments parentéraux.
Suppléments ZNCL2 Ils sont fournis pour traiter la zone.
Peut vous servir: mélange homogène Suppléments ZNCL2 Ils doivent être utilisés lorsqu'il y a une carence en zinc. Auteur: Moakets. Source: Pixabay.
Suppléments ZNCL2 Ils doivent être utilisés lorsqu'il y a une carence en zinc. Auteur: Moakets. Source: Pixabay. Les individus en bonne santé l'acquièrent par la nourriture.
Il doit être fourni au moins 1 heure avant les repas ou 2 heures après ceux-ci, car certains aliments peuvent empêcher leur absorption. Chez les patients qui ont une irritation de l'estomac après le complément d'ingestion devraient l'ingestion avec des repas, mais de cette façon, le zinc sera moins biodispononable.
Dans les applications vétérinaires
Ses solutions ont été utilisées chez les animaux comme agent caustique pour brûler ou les fistules du corps de calcul, qui sont des connexions entre des organes qui ne sont ni normaux ni sains; sous forme de pâtes sert à traiter les ulcères et la chimiothérapie du cancer.
 Les solutions aqueuses de ZNCL2 Ils sont utilisés pour traiter les infections aux yeux des animaux. Auteur: Mabel Amber. Source: Pixabay.
Les solutions aqueuses de ZNCL2 Ils sont utilisés pour traiter les infections aux yeux des animaux. Auteur: Mabel Amber. Source: Pixabay. Dans les infections oculaires.
Il est également utilisé comme traces dans les aliments pour animaux ou comme complément alimentaire.
En ciments spéciaux
La réaction entre le ZNCL2 Et le ZnO dans l'eau produit de l'oxychlorure de zinc qui constitue un matériau extrêmement dur ou en ciment. Les principaux constituants sont 4zno • Zncl2• 5h2O et ZnO • Zncl2• 2h2SOIT.
Ce type de ciments résiste à l'attaque de l'acide ou de l'eau bouillante. Cependant, le pentahydrate est très stable et insoluble mais immuable, et le dihydrate est plus soluble et peut provoquer un drainage liquide.
Pour ces raisons, ces ciments ont peu d'applications.
Comme catalyseur
Il sert à accélérer certaines réactions de chimie organique. Agit comme un agent du condenseur. Par exemple, dans les réactions aldoliques, les réactions d'amination et les réactions d'addition de cycle. Dans certains de ces actes comme un initiateur radical.
Il s'agit d'un acide de Lewis et catalyse les réactions de Diels-Alder. Il est également utilisé comme catalyseur dans les réactions de Friedel-Crafts, pour fabriquer des colorants et des colorants, et dans la fabrication de résines polyester-politiques.
Vous trouverez ci-dessous une réaction dans laquelle ce composé intervient:
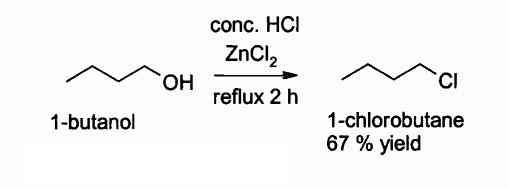 Réaction d'obtenir un chlorure d'alkyle à l'aide de ZNCL2. Auteur: Walkerma. Source: Wikimedia Commons.
Réaction d'obtenir un chlorure d'alkyle à l'aide de ZNCL2. Auteur: Walkerma. Source: Wikimedia Commons. Dans les activités agricoles
Il a été utilisé comme herbicide dans les cultures, comme traitement foliaire, pour éliminer les ravageurs tels que les champignons et la mousse, et comme micronutriment. Il est intermédiaire de préparer des pesticides.
Dans les applications dentaires
Il est utilisé dans les lavages en bouche, mais le temps de contact recommandé est très court, donc il n'agit que comme astringent dans la muqueuse buccale. Il sert de désensibilisation, il est utilisé dans les pâtes dentifriques et fait partie des ciments dentaires.
Peut vous servir: chlorite de sodium (Naclo2): structure, propriétés, utilisations, risquesDans l'industrie du textile et du papier
C'est un ingrédient du solvant qui est utilisé dans la fabrication de la rayonne ou de la soie artificielle de la cellulose. Il s'agit d'une réticulation ou d'un agent syndical pour les résines terminées sur les textiles. Il sert également à les traiter et à favoriser leur conservation.
Il permet de boucler des tissus, de séparer les fibres de soie et de laine et agit comme un mordant dans l'impression et la coloration des textiles.
Il est utilisé dans la fabrication de rouleaux de papier et pour produire du papier crêpe.
Dans la préparation des nanoparticules
En réagissant au chlorure de zinc avec du sulfure de sodium (na2S) à travers une méthode sonochimique et en présence de certains composés organiques, des nanoparticules de sulfure de zinc (ZN) sont obtenues. Les méthodes sonochimiques utilisent des ondes sonores pour provoquer des réactions chimiques.
Ce type de nanomatériaux pourrait avoir une application en tant qu'agents photocatalytiques à produire, par exemple, la division de l'eau dans ses composants (hydrogène et oxygène) par l'action de la lumière.
Dans plusieurs applications
- Déodorant, antiseptique et désinfectant des zones. Contrôle des mousse, des moisissures et des champignons dans les structures et zones adjacentes extérieures telles que les trottoirs, les cours et les clôtures. Désinfectant des toilettes, des tapis urinaires et du bois comprimé.
- Utilisé dans des mélanges pour les embaumeurs et les solutions pour la conservation des spécimens anatomiques.
- Retardateur de flamme en bois.
- Ingrédient primaire dans les pompes à fumée utilisées pour disperser une multitude de personnes; Les pompiers les utilisent dans les exercices et les pratiques de lutte contre l'incendie.
 Le chlorure de CINC est utilisé dans les pompes à fumée utilisées dans les exercices militaires. OU.S. Département de la Défense Photoscpl actuel. Abraham Lopez / 2nd Marine Division / Domaine public. Source: Wikimedia Commons.
Le chlorure de CINC est utilisé dans les pompes à fumée utilisées dans les exercices militaires. OU.S. Département de la Défense Photoscpl actuel. Abraham Lopez / 2nd Marine Division / Domaine public. Source: Wikimedia Commons. - Composant de flux de soudage. En enregistrement métallique. Pour la coloration en acier, composante de salle de bain galvanisée et en placage en fer avec cuivre.
- Dans les ciments de ciment en magnésium et métal.
- Pour briser les émulsions dans le raffinage d'huile. Agent en fabrication d'asphalte.
- Électrolyte dans des batteries séchées.
 Batterie sécher ZNCL2. Utilisateur: 32bitmaschine; Édité par l'utilisateur Jaybear / CC By-S (https: // CreatiVecommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Batterie sécher ZNCL2. Utilisateur: 32bitmaschine; Édité par l'utilisateur Jaybear / CC By-S (https: // CreatiVecommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. - Vulcanisation du caoutchouc.
- Agent déshydratant.
Des risques
Il peut provoquer des brûlures aux yeux, à la peau et aux muqueuses.
Lorsqu'il est chauffé à sa décomposition, il émet un chlorure d'hydrogène toxique (HCL) et de l'oxyde de zinc (ZnO).
Avertissement de son utilisation comme médicament
Bien que des études concluantes soient manquantes, on estime que si ce composé est administré aux femmes enceintes, elle peut endommager le fœtus. Mais les avantages potentiels pourraient avoir plus de poids que les risques possibles.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Chlorure de chlorure. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Liska, m. et al. (2019). Ciment spécial. Ciment oxychlorure de zinc. Dans Lea's Chemistry of Cement and Concrete (cinquième édition). Récupéré de ScienceDirect.
- Pohanish, R.P. (2017). Chlorure de chlorure. Dans le manuel de Sittig de produits chimiques et de Carcinages toxiques et dangereux (septième édition). Récupéré de ScienceDirect.com.
- Gedanken, un. et perelshtein, je. (2015). Échographie de puissance pour la production de nanomatériaux. En échographie de puissance. Récupéré de ScienceDirect.
- Archibald, s.J. (2003). Groupes de métaux de transition 9-12. Réactions et catalyse. Dans la compréhension de la coordination Chemistry II. Récupéré de ScienceDirect.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- « Structure du chromate de zinc, propriétés, obtenant, utilisations
- Structure du nitrate de zinc, propriétés, obtenant, utilisation »

