Structure de nitrate de sodium (Nano3), propriétés, utilisations, risques

- 3344
- 411
- Justine Charpentier
Il nitrate de sodium C'est un solide inorganique cristallin formé par une na ion sodium+ et un nitrate ion non3-. Sa formule chimique est nano3. Dans la nature, il se trouve comme le minéral de nitratine ou de nitratite, qui est en abondance dans le désert d'Atacama au Chili, donc ce minéral est également appelé Salitre de Chili ou Caliche.
Le nitrate de sodium est un solide non combustible mais peut accélérer l'oxydation ou la combustion de matériaux inflammables. Pour cette raison, il a une large utilisation dans les feux d'artifice, dans les explosifs, dans les matchs, dans les briques de charbon et dans certains types de pesticides, pour éliminer les rongeurs et autres petits mammifères.
 Nitratine ou nitratita, nano sodium nitrate minéral3. John Sobolewski (JSS) [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons.
Nitratine ou nitratita, nano sodium nitrate minéral3. John Sobolewski (JSS) [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons. La capacité de favoriser la combustion ou l'allumage des autres matériaux signifie qu'elle doit être manipulée avec une grande prudence. S'il est exposé aux flammes ou aux incendies, il peut exploiter. Malgré cela, le nano3 Il est utilisé dans l'industrie alimentaire car il possède des propriétés conservatrices, en particulier les viandes et certains types de fromages.
Cependant, leur ingestion excessive peut causer des problèmes de santé, en particulier chez les femmes enceintes, les bébés et les enfants. Lors de la transformation en nitrites dans le système digestif peut provoquer certaines maladies.
[TOC]
Structure chimique
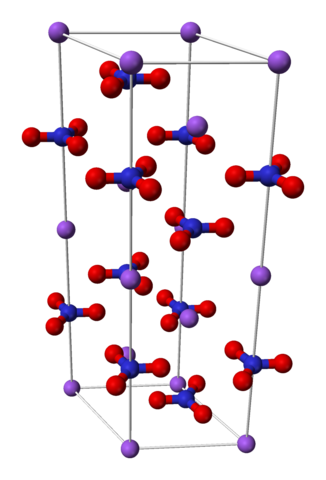 Nano3 Romboédrica Unitary Cell. Source: Benjah-Bmm27 [domaine public]
Nano3 Romboédrica Unitary Cell. Source: Benjah-Bmm27 [domaine public] Le nitrate de sodium est constitué d'un na cation sodium+ et un anion nitrate non3-.
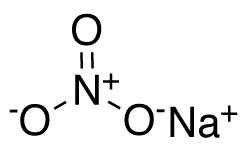 Nano nitrate de sodium3. Ccroberts [domaine public]. Source: Wikimedia Commons.
Nano nitrate de sodium3. Ccroberts [domaine public]. Source: Wikimedia Commons. Dans l'anion nitrate non3- L'azote N a une valence de +5 et de l'oxygène A de valence de -2. Pour cette raison, l'anion nitrate a une charge négative.
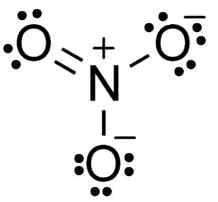 Structure de nitrate ion lewis. TEM5PSU [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Structure de nitrate ion lewis. TEM5PSU [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. L'anion non3- Il a une structure plate et symétrique, dans laquelle les trois oxygens distribuent la manière négative ou uniforme.
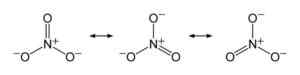 Dans l'ion nitrate, la charge négative est répartie également entre les trois atomes d'oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Dans l'ion nitrate, la charge négative est répartie également entre les trois atomes d'oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Nomenclature
-Nitrate de sodium
-Nitrate de sodium
-Saltpeter de sodium (anglais Salpêtre de sodium)
-Nitro Soda (anglais Soda)
-Salitre de Chili
-Nitrate chilien
-Nitratine
-Nitratita
-Caliche
Propriétés
 Cristaux romboédiques de nitrate de sodium obtenus à partir d'une solution sursaturée de celui-ci. Source: Vadim Sedov [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]
Cristaux romboédiques de nitrate de sodium obtenus à partir d'une solution sursaturée de celui-ci. Source: Vadim Sedov [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] État physique
Couleur incolore aux cristaux blancs, trigonaux ou rhomboédicaux.
Poids moléculaire
84 995 g / mol
Point de fusion
308 ºC
Point d'ébullition
380 ºC (décomposer).
Densité
2 257 g / cm3 à 20 ºC.
Solubilité
Soluble d'eau: 91,2 g / 100 g d'eau à 25 ºC ou 1 g dans 1,1 ml d'eau. Légèrement soluble dans l'éthanol et le méthanol.
pH
Les solutions de nitrate de sodium sont neutres, c'est-à-dire ni acide ni basique, donc son pH est 7.
Autres propriétés
C'est un solide hygroscopique, c'est-à-dire qu'il absorbe l'eau de l'environnement.
 Nano nitrate de sodium3 solide. Ondřej MANGL [Domaine public]. Source: Wikimedia Commons.
Nano nitrate de sodium3 solide. Ondřej MANGL [Domaine public]. Source: Wikimedia Commons. Sa dissolution de l'eau fait refroidir la solution, il est donc dit que ce processus de dissolution est endothermique, en d'autres termes, lors de sa dissolution absorbe la chaleur de l'environnement et donc la solution refroidit.
Peut vous servir: carbone primaire: caractéristiques, types et exemplesÀ très basses températures, le nitrate de sodium est soluble dans l'ammonia NH liquide3, formant nano3· 4NH3 En dessous de -42 ºC.
Nano3 Ce n'est pas du carburant, mais sa présence accélère la combustion de matériaux ou de composés qui sont. C'est parce que lorsqu'il est chauffé, oxygène ou2, entre autres gaz.
Obtention
Il est obtenu principalement par extraction des dépôts minéraux ou des mines de Salitre de Chili (caliche ou nitratita). Pour cela, la saumure est utilisée puis la cristallisation et la recristallisation sont réalisées pour obtenir des nano-cristaux3 le plus pur.
Ces mines se trouvent principalement en Amérique du Sud dans le nord du Chili dans le désert d'Atacama. Il est associé au nitrate de potassium kno3 et pour décomposer la matière organique.
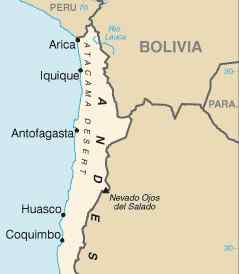 Emplacement du désert d'Atacama dans le nord du Chili, où il y a d'importants dépôts de nitrate de sodium. CIA [domaine public]. Source: Wikimedia Commons.
Emplacement du désert d'Atacama dans le nord du Chili, où il y a d'importants dépôts de nitrate de sodium. CIA [domaine public]. Source: Wikimedia Commons. Il peut également être obtenu en réagissant à l'acide nitrique avec du carbonate de sodium Na2CO3 ou avec l'hydroxyde de sodium NaOH:
2 HNO3 + N / A2CO3 → 2 nano3 + CO2↑ + H2SOIT
Présence dans l'organisme humain
Le nitrate de sodium peut entrer dans l'organisme humain par la nourriture et les boissons qui le contient.
60 à 80% du nitrate ingéré provient de fruits et légumes. Une deuxième source est des viandes guéris. L'industrie de la viande l'utilise pour empêcher la croissance des microbes et conserver la couleur.
Cependant, une proportion élevée du nitrate présent dans le corps humain provient de sa synthèse endogène ou due à des processus au sein de l'organisme.
Applications
Dans l'industrie alimentaire
Il est utilisé comme conservateur alimentaire, comme agent de durcissement pour les viandes marinées et comme agent de rétention des couleurs pour les viandes. Les aliments qui peuvent le contenir sont du bacon, des saucisses, du jambon et certains fromages.
 Viandes séchées qui contiennent probablement du nitrate de sodium. Auteur: Falco. Source: Pixabay.
Viandes séchées qui contiennent probablement du nitrate de sodium. Auteur: Falco. Source: Pixabay. En engrais
Le nitrate de sodium est utilisé dans les mélanges d'engrais pour fertiliser le tabac, le coton et les cultures de légumes.
 Tracteur fertilisant une plantation. Auteur: Franck Barske. Source: Pixabay.
Tracteur fertilisant une plantation. Auteur: Franck Barske. Source: Pixabay. En tant que promoteur ou flatteur de combustion ou d'explosion
Nano3 Il est utilisé comme oxydant dans de nombreuses applications. Il s'agit d'un solide riche en oxygène qui facilite le processus d'allumage par la production de ou2.
La présence du nano3 fait que les matériaux ne nécessitent pas d'oxygène provenant de sources externes pour s'enflammer car cela fournit suffisamment ou2 Quant aux réactions exothermiques de l'auto-conservation (générateurs de chaleur) qui se produisent pendant l'inflammation ou l'explosion.
Il est utilisé depuis longtemps comme oxydant principal dans les matériaux pyrotechniques (feux d'artifice), comme composant oxydant dans les explosifs et les agents de détonation ou les rafales et en tant qu'agent propulseur.
Peut vous servir: composé chimique Feux d'artifice. Dans sa composition, il y a du nano nitrate de sodium3. Auteur: Watplaid. Source: Pixabay.
Feux d'artifice. Dans sa composition, il y a du nano nitrate de sodium3. Auteur: Watplaid. Source: Pixabay. Il est également utilisé pour améliorer la combustion des briques de charbon (briquetas), pour favoriser l'allumage dans les matchs et même pour améliorer les propriétés combustibles du tabac.
Pour éliminer les rongeurs et autres mammifères
Il est utilisé pour un type spécial de pesticides. Les compositions qui le contiennent sont des fumigants pyrotechniques placés et brûlés dans des terriers libérant des doses mortelles de gaz toxiques.
Pour cette raison, il est utilisé pour le contrôle de plusieurs rongeurs, marmotes, coyotes et mouffettes, dans les champs ouverts, les prairies, les zones non culturelles, les Céspedes et les champs de golf.
Dans la préparation d'autres composés
Il est utilisé dans la fabrication d'acide nitrique HNO3, Nano sodium nitrite2, et agit également comme un catalyseur dans la préparation de l'acide sulfurique H2Swin4.
Il est utilisé dans la fabrication d'oxyde nitreux n2O et comme agent oxydant dans la fabrication de composés pharmaceutiques.
Dans l'extraction des métaux électroniques
Certains chercheurs ont découvert que le nano3 Facilite l'extraction non polluante des métaux contenus dans l'équipement électronique (téléphones cellulaires, tablettes, ordinateurs, etc.).
Les métaux utiles qui peuvent être extraits des composants de ces équipements électroniques sont Nickel Ni, Cobalt Co, Manganese MN, Zinc Zn, Copper Cu et Aluminium.
L'extraction se fait en utilisant une seule solution de nano3 et un polymère. Et un rendement de 60% est atteint.
De cette façon, les déchets électroniques peuvent être recyclés contribuant à la minimisation des déchets et à la récupération stable des ressources.
Dans la recherche sur la santé et l'exercice
Selon certaines études, l'ingestion de suppléments nano3 ou les aliments qui le contiennent ont naturellement des effets positifs sur la santé. Certains des aliments riches en nitrates sont la betterave, les épinards et la roquette.
Parmi les effets, il y a pour améliorer le système cardiovasculaire, réduire la pression artérielle, améliorer le flux sanguin et augmenter la quantité d'oxygène dans les tissus qui sont physiquement exercés.
Cela indique que l'utilisation de nano pourrait être considérée3 comme un médicament à faible coût dans la prévention et le traitement des patients souffrant de problèmes de pression artérielle.
De plus, cela peut servir d'aide efficace et naturelle à augmenter la puissance musculaire chez les athlètes.
Dans plusieurs utilisations
 Affiche publicitaire du XXe siècle, incitant à payer le terrain avec le nitrate du Chili. David Perez [domaine public]. Source: Wikimedia Commons.
Affiche publicitaire du XXe siècle, incitant à payer le terrain avec le nitrate du Chili. David Perez [domaine public]. Source: Wikimedia Commons. Il est utilisé comme un agent oxydant et fondateur dans la fabrication de lunettes et d'émaux pour la céramique. Il est également utilisé dans des ciments spéciaux.
Il sert d'agent chimique dans la récupération de l'étain à partir de métal indésirable, en coagulation en latex, dans l'industrie nucléaire et dans le contrôle de la corrosion dans les systèmes aqueux.
Il peut vous servir: disposio: structure, propriétés, obtention, utilisationsDes risques
Dangers de sa manipulation
Il a la propriété d'accélérer la combustion de matériaux inflammables. Si vous êtes impliqué dans un incendie, une explosion peut se produire.
Lorsqu'il est exposé à la chaleur ou au feu peut être exploité, produisant des oxydes d'azote toxiques.
Problèmes liés à votre ingestion à la nourriture ou à l'eau
Le nitrate lorsqu'il est ingéré peut devenir du nitrite à la fois dans la bouche et l'estomac et les intestins.
Le nitrite lorsqu'il réagit avec les amines présentes dans certains aliments peut devenir de la nitrosamine dans un milieu acide comme dans l'estomac. La nitrosamine est cancérigène.
Cependant, cela ne se produit pas lorsque les fruits et légumes contenant des nitrates sont ingulés naturellement.
Selon certaines études, la présence de niveaux de nitrate élevés peut produire un trouble sanguin qui fait libérer efficacement l'oxygène dans les tissus.
Cela peut se produire chez les bébés dont la formule laitière est préparée avec de l'eau contenant des nitrates.
Il a également été observé que des niveaux élevés de nitrate peuvent générer des problèmes de gestation des bébés, provoquant des avortements spontanés, des naissances ou des défauts prématurés dans le tube neural des fœtus.
Récemment, il a été constaté que le nitrate de sodium peut signifier un risque de développement du système musculo-squelettique et que la communication nerveuse-musculaire est affectée chez l'homme.
Nitrate de sodium dans la nourriture
 Le nitrate de sodium se trouve comme additif dans le bacon et autres produits de viande. Source: CookBookman17 via Flickr (https: // www.Flickr.com / photos / [e-mail protège] / 6175755733)
Le nitrate de sodium se trouve comme additif dans le bacon et autres produits de viande. Source: CookBookman17 via Flickr (https: // www.Flickr.com / photos / [e-mail protège] / 6175755733) Le nitrate de sodium est synonyme de viande, car avec le nitrite, ils leur sont ajoutés dans le but de les conserver et d'améliorer leur apparence et leurs saveurs. Pour sa cause, une consommation excessive de viandes (perrocalientes, bacon, jambons, poissons fumés, etc.) a été impliqué dans le lien inquiétant des cancers de tout le système digestif.
Bien que la relation entre la viande traitée avec des sels de nitrate-nitrite et le cancer ne soit pas absolue, il est recommandé de modérer son apport.
D'un autre côté, les légumes (carottes, betteraves, radis, laitue, épinards, etc.) Ils sont riches en nano3 Puisqu'ils l'ont absorbé par les sols de culture en raison de leur action d'engrais. L'apport de ces légumes, contrairement à celui des produits de viande, n'est pas lié aux maladies citées.
Cela est dû à deux raisons: la différence dans les niveaux de protéines de ces aliments et la façon dont ils cuisinent. Les viandes lors de la friture ou du chauffage à la flamme favorisent la réaction entre les nitrates-nitrites avec certains groupes d'acides aminés, pour produire des nitrosoamines: de vrais agents cancérigènes.
La teneur en vitamine C, fibre et polyphénols dans les légumes réduit la formation de ces nitrosoamines. C'est pourquoi le nano3 Il ne s'agit pas d'une menace pour la nourriture.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Nitrate de sodium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. VCH VERLAGSGELLSCHAFT MBH.
- Couletal, h.R. et Ravanbod, m. (2015). Étude cinétique de Mg / Nano3 pyrotechnique en utilisant une technique TG / DSC non oposathermale. J Therm Anal Calim (2015) 119: 2281-2288. Lien récupéré.Springer.com.
- Jarosz, J. et al. (2016). Le nitrate de sodium diminue le récepteur du regroupement d'acétylcholine induit. BMC Pharmacology and Toxicology (2016) 17:20. Récupéré de bmcpharmacoltoxicol.biomedcentral.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Privé, m.J. (2003). Cancer. Carcinagens dans la chaîne alimentaire. Dans l'encyclopédie des sciences alimentaires et de la nutrition (deuxième édition). Récupéré de ScienceDirect.com.
- Zakhodyaeva, et.POUR. et al. (2019). Extraction complexe de métaux dans un système aqueux biphasé à base de poly (oxyde d'éthylène) 1500 et de nitrate de sodium. Molécules 2019, 24, 4078. MDPI a récupéré.com.
- Clements, W.T. et al. (2014). Ingestion de nitrate: un examen des effets de la santé et des performances physiques. Nutriments 2014, 6, 5224-5264. MDPI a récupéré.com.
- « 6 Avantages et inconvénients des présentations numériques
- Évolution de l'entretien industriel de l'origine »

