Structure de nitrate de plomb, propriétés, obtention, utilisations

- 2946
- 164
- Eva Henry
Il nitrate de plomb o Le nitrate de plomb (II) est un composé inorganique formé par des éléments de plomb (PB), de l'azote (N) et de l'oxygène (O). Le plomb est trouvé comme ion pb2+ Et l'azote et l'oxygène forment l'ion nitrate3-.
Sa formule chimique est PB (non3)2. C'est un solide cristallin blanc très soluble dans l'eau, où il forme des ions PB2+ et non3-. Il est également connu sous le nom de nitrate de plombose car le plomb est dans son état d'oxydation le plus bas.
 Nitrate de plomb solide. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons.
Nitrate de plomb solide. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons. Il a des propriétés fortement oxydantes, il est donc utilisé dans des applications où cette caractéristique est nécessaire, comme dans la préparation de divers composés organiques et en tant que réactif de laboratoire.
Dans le passé, il a été largement utilisé pour préparer des couleurs basées au plomb, où elle a également agi comme un fixateur des couleurs dans les tissus. Cette application a été abandonnée en raison de la toxicité de tête.
Il a été utilisé dans l'industrie métallurgique de diverses manières, et récemment son utilité s'est avérée se former, ainsi que d'autres composés, des matériaux à forte capacité d'absorption de lumière et une transformation de ceci en électricité.
Cependant, c'est une substance dangereuse car elle peut favoriser la génération d'incendie. Il est également toxique pour l'être humain, les animaux et les plantes, il ne devrait donc jamais être jeté dans l'environnement.
[TOC]
Structure
C'est un composé ionique formé par un cation Pb2+ et deux anions non3-. Dans l'anion nitrate, l'oxygène est disposé symétriquement autour de l'azote et alternative à double liaison avec ce.
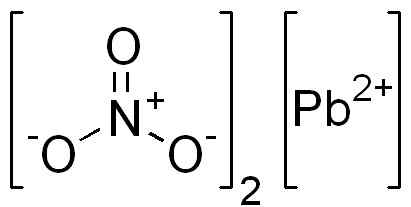 Structure PB (non3)2. Domaine EDGAR181 / Pub. Source: Wikimedia Commons.
Structure PB (non3)2. Domaine EDGAR181 / Pub. Source: Wikimedia Commons. 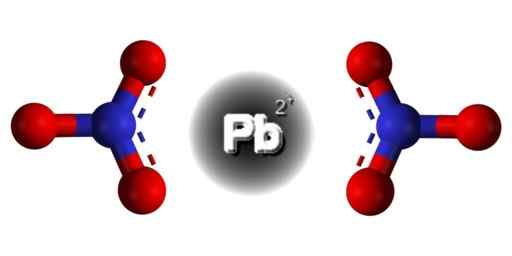 Structure spatiale de Pb (non3)2. Gris = plomb; bleu = azote; Rouge = oxygène. Claudio Pistilli / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Structure spatiale de Pb (non3)2. Gris = plomb; bleu = azote; Rouge = oxygène. Claudio Pistilli / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Le plomb dans ce composé a la configuration électronique suivante:
[Xe] 4F14 5ddix 6s2 6p0, où il est observé qu'il a perdu les 2 électrons de la dernière couche.
Peut vous servir: quel est l'élément le plus électronégatif et pourquoi?Nomenclature
- Nitrate de plomb
- Nitrate de plomb (II)
- Nitrate de plomboso
- Dinitrate de tête
Propriétés
État physique
Solide cristallin blanc ou incolore. Cristaux cubes.
Poids moléculaire
331 g / mol
Point de fusion
470 ºC. Selon certaines sources, elle se décompose à cette température.
Densité
4,53 g / cm3
Solubilité
Très soluble dans l'eau: 59,7 g / 100 ml d'eau à 25 ° C. Un peu soluble dans l'éthanol. Insoluble dans l'acide nitrique (HNO3) concentré.
pH
Une solution aqueuse avec 20% de PB (non3)2 Il a un pH de 3,0-4,0.
Propriétés chimiques
Est un agent oxydant. Réagit violemment avec les matériaux et les réducteurs combustibles.
Ce n'est pas du carburant mais peut accélérer la combustion de matériaux qui sont. Si vous chauffez jusqu'à sa décomposition émet des gaz d'oxyde d'azote toxiques:
2 PB (non3)2 + Chauffer → 2 Pbo + 4 Non2↑ + o2↑
Lors de la dissolution dans l'eau, il est ionisé:
PB (non3)2 + H2O → PB2+ + 2 Non3-
Obtention
Il peut être préparé en réagissant le plomb métallique, le monoxyde de plomb (PBO) ou le carbonate de plomb3 Avec de l'acide nitrique. Il est pratique d'utiliser un excès d'acide pour empêcher les nitrates de base.
PBO + 2 HNO3 (concentré) → Pb (non3)2↓ + H2SOIT
Applications
Biologique
Sa capacité oxydante a une application dans la préparation de divers composés.
Il a été utilisé pour synthétiser les calixarenos, qui sont des composés organiques dont la molécule a la forme d'un panier qui permet d'héberger d'autres substances en fonction de l'utilisation qui lui sera donné.
Il sert à obtenir des isotiociens (R-CS) à partir des amines (R-NH2).
Il est utilisé à une échelle industrielle pour préparer le chlorure de benchilo oxydant le benzaldéhyde. Il sert également de catalyseur pour l'estérification des composés organiques, par exemple dans l'obtention de polyesters.
En analyse chimique
Il est utilisé comme réactif dans la détermination de l'aluminium et du plomb dans les minéraux et les roches.
Dans la coloration des fibres textiles
Certains colorants chromés nécessitent l'utilisation de PB (non3)2 obtenir. Par exemple, pour teindre le coton jaune, il est recouvert de nitrate de plomb et est traité avec du sulfate de sodium pour produire du sulfate de plomb.
Peut vous servir: poids équivalentEnsuite, une solution diluée de dichromate de sodium est appliquée pour former du chromate de plomb (PBCRO4) C'est un pigment jaune.
 Il y a un temps, les tissus jaunes étaient colorés de pigments dont le point de départ était PB (non3)2. Cela ne se fait pas par la toxicité principale. Auteur: 3D Animation Production Company. Source: Pixabay.
Il y a un temps, les tissus jaunes étaient colorés de pigments dont le point de départ était PB (non3)2. Cela ne se fait pas par la toxicité principale. Auteur: 3D Animation Production Company. Source: Pixabay. Cependant, aujourd'hui, les pigments de plomb pour leur toxicité ont cessé d'utiliser.
Il agit également comme un mordant pour fixer les colorants pendant la couleur ou l'impression d'autres types de fibres.
Dans le vétérinaire de médina
Il était autrefois utilisé comme agent caustique dans le traitement des chancros ou des gangrenas chez les chevaux.
Dans l'industrie du métal
Le nitrate de plomb est utilisé dans le raffinage électrolytique du plomb, en tant qu'agent pour favoriser la flottaison dans l'élimination du titane de certaines argiles, permet de récupérer des métaux précieux de solutions de cyanure et est utilisé dans l'électrode PBO2 à Nickel Anodes.
Dans les cellules solaires
Il a été utilisé sous forme de solution aqueuse pour fabriquer des cellules solaires basées sur Perovskita, un minéral d'oxyde de titane.
Le matériau synthétisé est un organométallique ou pervskita d'iodure de plomb qui a attiré l'attention des chercheurs, car il a une capacité d'absorption de lumière élevée et une grande longueur de diffusion des porteurs de charge.
Ces caractéristiques en font un excellent candidat pour les appareils photovoltaïques, c'est-à-dire qu'ils transforment la lumière en courant électrique.
 Microphotographie de la structure de Unavskita de l'halogénure de plomb prise avec un microscope à fluorescence. Furava / cc by (https: // CreativeCommons.Org / licences / par / 4.0). Source: Wikimedia Commons.
Microphotographie de la structure de Unavskita de l'halogénure de plomb prise avec un microscope à fluorescence. Furava / cc by (https: // CreativeCommons.Org / licences / par / 4.0). Source: Wikimedia Commons. Autres applications
Il (PBNO3)2 Il a également été utilisé:
- Dans la fabrication de matchs, certains explosifs et matériaux pyrotechniques,
- En photographie en tant qu'agent sensibilisant pour couvrir l'article en photothermographie,
- Dans l'industrie textile pour améliorer la rayonne et stabiliser le nylon,
- Dans l'élimination des rongeurs.
 Le nitrate de plomb a été utilisé pour fabriquer des feux d'artifice ou des matériaux pyrotechniques. Auteur: Free-Goos. Source: Pixabay.
Le nitrate de plomb a été utilisé pour fabriquer des feux d'artifice ou des matériaux pyrotechniques. Auteur: Free-Goos. Source: Pixabay. Des risques
Feu et explosion
Bien qu'il ne s'agisse pas d'un composé de carburant, s'il est exposé au feu ou à la chaleur, il peut exploser, générant des oxydes d'azote toxiques.
Étant un agent fortement oxydant, il y a un danger qu'un incendie soit généré s'il entre en contact avec les matériaux organiques.
Pour la santé
Produit une irritation des yeux, un tube respiratoire et digestif. Il est toxique par inhalation et ingestion. Les symptômes d'empoisonnement les plus courants par ce composé sont gastro-intestinaux, coliques, constipation et faiblesse qui peuvent devenir la paralysie de certains muscles, entre autres, entre autres.
Son ingestion peut également provoquer de la douleur, des crampes, de la dépression, du coma et de la mort.
Pour l'environnement naturel
Il est toxique pour les organismes aquatiques et terrestres, en outre leurs dommages sont persistants et bioaccumumules dans les êtres vivants, il est donc considéré comme un polluant dangereux et ne doit pas être jeté à l'environnement.
Si par accident, il est renversé dans l'eau, il doit être neutralisé avec l'oxyde de calcium (CaO), le carbonate de calcium (CACO3) ou bicarbonate de sodium (NAHCO3).
Il a été confirmé qu'il est cancérogène pour les animaux et peut-être pour l'être humain.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Plomb (ii) nitrate. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Hsih, t.ET. et al. (2015). Cellule solaire posvskite efficace fabriquée à l'aide d'un précurseur de nitrate de plomb aqueux. Chem Commun (changement). 4 sept. 2015; 51 (68): 13294-7. NCBI a récupéré.NLM.NIH.Gouvernement.
- Vratny, f. et Gugliotta, F. (1963). La décomposition thématique du nitrate de plomb. J. Inorg. Nucl. Chem., 1963, vol. 25, pp. 1129-1132. Récupéré de ScienceDirect.com.
- Chakraborty, J.N. (2014). Teinture avec les couleurs minérales. Dans les fonds et les pratiques dans ColorAction of Textiles. Récupéré de ScienceDirect.com.
- Kumari, h. Et Atwood, J. (2017). Calixarenes à l'état solide. En référence module en chimie, sciences moléculaires et génie chimique. Récupéré de ScienceDirect.com.
- Jeffery, P.g. et Hutchison, D. (1981). Aluminium. Dans les méthodes chimiques de l'analyse des roches (troisième édition). Récupéré de ScienceDirect.com
- Sandler, S.R. et karo, w. (1992). Cyanates, isocyanates, thiocyanates et isothiocyanates. Dans Sourcebook of Advanced Organic Laboratory Préparation. Récupéré de ScienceDirect.com.
- Smith, P.W.g. et al. (1969). Composés halogènes aromatiques. En chimie aromatique. Récupéré de ScienceDirect.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Fondation Wikimedia (2020). Plomb (ii) nitrate. Récupéré de.Wikipédia.org.
- Shinde, D.V. et al. (2017). Efficie et stabilité améliorées d'une cellule solaire de pérovskite organométallique aqueuse à base de nitrate de plomb. ACS Appl. Mater. Interfaces 2017, 9, 14023-14030. Récupéré des pubs.ACS.org.
- « Phénols ou propriétés de composés phénoliques, types, applications
- Structure de l'acétate de plomb, propriétés, obtention, utilisations »

