Modèles atomiques
- 4029
- 879
- Lucas Schneider
 Les modèles atomiques sont les différentes représentations graphiques qui ont été données aux atomes à travers l'histoire. Volet
Les modèles atomiques sont les différentes représentations graphiques qui ont été données aux atomes à travers l'histoire. Volet Quels sont les modèles atomiques?
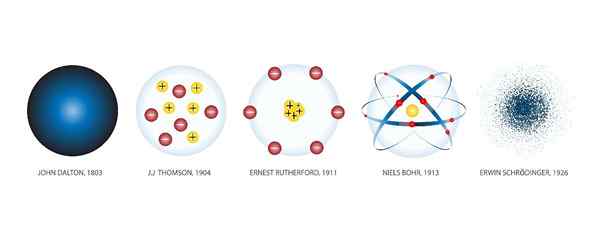
Les Modèles atomiques Ce sont des représentations graphiques de la structure et du fonctionnement d'un atome. Il y a eu de nombreux modèles à travers l'histoire.
En effet. A cette époque, l'atome n'était qu'un produit de spéculation philosophique.
Au fur et à mesure que de nouvelles découvertes scientifiques ont été faites, de nouveaux modèles ont été créés pour intégrer les connaissances acquises. Et donc cela s'est produit du siècle après le siècle jusqu'à aujourd'hui, lorsque la technologie nous a permis d'observer les atomes par microscopes et de déterminer le modèle correct.
Que sont les atomes?
Les atomes sont des structures submicroscopiques dont tout le sujet que nous percevons est formé et avec lequel nous interagissons tous les jours, de notre propre corps, la nourriture que nous mangeons, les vêtements que nous portons, aux grands gratte-ciel et aux avions.
De plus, le soleil, la lune, les planètes, les étoiles et les galaxies se forment avec des atomes.
Ceux-ci sont si petits qu'ils ne peuvent pas être vus avec des microscopes communs. D'autres sont nécessaires à une plus grande puissance, appelée ultramicroscopes. Cependant, les atomes ne sont pas les plus petites unités de la nature.
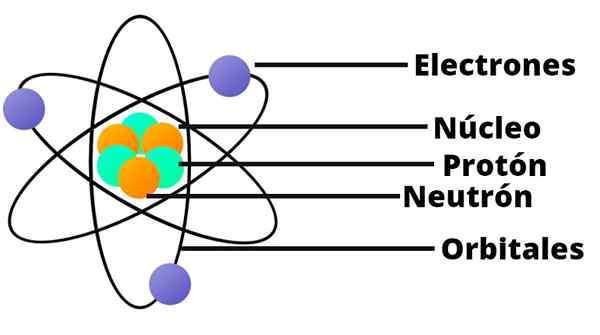
Les atomes se forment à leur tour par des particules encore plus petites: protons, neutrons et électrons.
Les protons ont une charge électrique positive, tandis que les neutrons n'ont pas de charge électrique. Ces deux types de particules forment le noyau de l'atome.
Les électrons sont des électrons, qui ont une charge électrique négative.
Modèle atomique de démocrite

Democrit of Abdera était un philosophe grec qui vivait entre 460 et 370 avant l'ère actuelle. Il a affirmé que toute la matière était formée par de minuscules particules, il a appelé les atomes, qui en grec signifie indivisible.
Selon Democritus, l'atome est la plus petite partie dans laquelle la question peut être divisée. Il y en a un nombre infini, qui sont indestructibles, incroyables, éternels et absolument compacts, sans pores. Il existe plusieurs types, qui diffèrent par la forme, l'ampleur, la position et la façon dont ils sont disposés.
Il peut vous servir: catastrophes causées par l'être humain lors de l'utilisation de la science et de la technologieLa théorie du démocrite a été rejetée par Aristote puis totalement oubliée jusqu'à l'émergence de la science moderne.
Modèle atomique de Dalton

John Dalton (1766-1844) était un météorologue anglais intéressé à enquêter sur les lois qui régissent le comportement du gaz. Le fruit de son travail dans ce domaine a été le premier modèle atomique de la science moderne, qu'il a fait en 1803.
Étant donné que l'existence de protons et d'électrons n'avait pas encore été découverte, Dalton a déclaré, comme Democritus, que l'atome est la plus petite partie dans laquelle la matière peut être divisée et, par conséquent, en soi, elle est indivisible.
Selon Dalton, les atomes sont solides et ont une forme sphérique, comme une balle de baseball. Dalton a illustré sa sculpture théorique en bois, ainsi que ses assistants, des dizaines de sphères qui représentaient des atomes de différents éléments chimiques.
Ce modèle était en vigueur jusqu'à la découverte de l'électron.
Modèle atomique Thomson
Le physicien anglais Joseph John Thomson (1865-1940) a dû faire l'une des découvertes les plus importantes de la science moderne: celle de l'électron.
C'était en 1897, dans le Cavendish Laboratory de l'Université de Cambridge, en Angleterre, où une plaque commémore toujours la grande découverte.
Thompson et ses assistants projettent les rayons de cathode sur un champ électrique. En contact avec le champ, les rayons ont dévié former des angles larges. Cela a confirmé que les rayons de cathode avaient une charge électrique négative. Ces particules chargées négativement les appelaient des électrons.
Thomson a supposé que les électrons étaient ancrés dans les atomes. Son modèle atomique date de 1904.
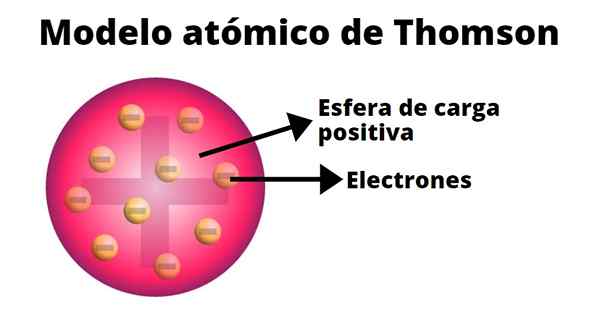
Le pudding des raisins secs
Dans le modèle atomique de Thompson, l'atome est une sphère solide avec une charge positive (protons) sur laquelle les neutrons (charge négative) sont distribués au hasard, alors que les raisins secs jetés sur pudin. C'est pourquoi ce modèle était connu sous le nom de "Pudin de Pasas".
Selon Thompson, l'atome a un rayon de 0,00000001 centimètres et sa charge est neutre, car les protons et les électrons ont la même charge, mais de signe opposé.
Le modèle Thompson ne présente pas de neutrons.
Modèle atomique de Rutherford
Ernest Rutherford (1871-1937), physicien néozyle, était l'un des étudiants les plus éminents de Thomson.
Peut vous servir: recherche corrélationnelleEn 1911, et sur la base de la découverte récente de la radioactivité, Rutherford a réalisé l'expérience suivante: ils ont tiré des particules radioactives alpha de grande vitesse et d'énergie contre une feuille d'or.
Si le modèle atomique Thompson était correct, les particules alpha traverseraient la feuille sans déviation ou avec une déviation insignifiante. Cependant, lorsqu'ils ont calculé l'angle de déviation par rapport aux particules, ils ont découvert qu'il était large, et que certains rebondissant même contre la feuille d'or.
Avec ce résultat, Rutherford a compris que l'atome devrait avoir un noyau très petit et très condensé. Ce noyau a été chargé positivement.
Un petit système solaire
Le modèle atomique de Rutherford est comme un système solaire miniature. Au centre, à l'endroit qui correspondait au soleil, il y a le noyau avec ses protons chargés positivement. Autour de cela, en orbite sous forme de planètes, il existe des électrons distribués au hasard.
Rutherford a également établi que la masse de l'atome équivaut à la somme des masses d'électrons et de protons.
Modèle atomique bohr
Bien que le modèle de Rutherford ait été une avance indéniable par rapport aux modèles précédents, il avait des défauts importants. Par exemple, si les électrons efficacement orbitaux autour du noyau, ils finiraient par perdre de l'énergie et s'effondrer sur le noyau. Mais cela ne s'est évidemment pas arrivé.
C'est le physicien danois Niels Bohr (1885-1962), étudiant de Rutherford à l'Université de Manchester (Angleterre), qui proposerait en 1913 un modèle atomique qui a résolu les problèmes posés par son ancien professeur.
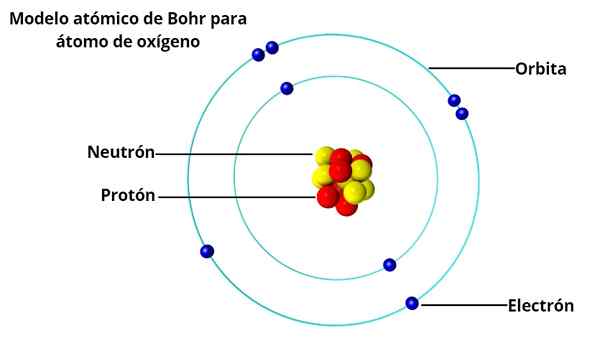
Orbites circulaires
Dans le modèle atomique de Bohr, les électrons ne se déshabillent pas librement autour du noyau, mais le faites dans des orbites circulaires stables, séparées les unes des autres, similaire à la façon dont les planètes du système solaire sont disposées. Chaque orbite est appelée énergie ou niveau d'énergie.
Sur la base des enquêtes sur Max Planck et Albert Einstein, il a déterminé que chaque électron sur leur orbite a une certaine quantité d'énergie.
Tout en orbiteuse stable autour du noyau, il est dit que les électrons sont à l'état stationnaire. D'un autre côté, lorsqu'un électron "saute" sur une orbite d'énergie inférieure, il y a un photon.
Peut vous servir: méthodologieCependant, le modèle Bohr n'a pas réussi à expliquer le fonctionnement des atomes avec plus d'un électron.
Modèle atomique Sommerfeld
Arnold Sommerfeld (1868-1951) était un physicien allemand qui a consacré son travail à l'élargissement du modèle atomique de Bohr. Ce modèle étendu a été présenté en 1916.
Basé sur la théorie de la relativité d'Einstein, Sommerfeld a découvert que certains électrons en orbite autour du noyau à des vitesses près de la lumière (300.000 kilomètres par seconde).
Il a également apporté les modifications suivantes au modèle Bohr:
- Les électrons se déplacent autour du noyau dans les orbites circulaires et elliptiques. Bohr uniquement des orbites circulaires.
- Dans le même niveau d'énergie, il y a des sous-niveaux avec des énergies légèrement différentes.
Modèle mécanique quantique (Broglie, Heisenberg et Schrödinger)
Il s'agit du modèle atomique le plus précis connu et actuellement accepté, avec quelques ajouts ultérieurs. Il a été développé par trois scientifiques: The German Werner Heisenberg (1901-1976), The Autrichien Erwin Schrödinger (1887-1961) et le Français Louis de Broglie (1892-1987).
Ce modèle rejette l'idée d'électrons qui orbitent le noyau. Au lieu de cela, nous avons des nuages électroniques, qui sont des espaces autour du noyau dans lequel il est possible de trouver un électron. Cela se comporte comme une vague stationnaire.
La probabilité de constater qu'elle est calculée avec une équation établie par Schrödinger.
Il s'agit du modèle mécanique quantique de l'atome qui a commencé à partir de l'équation de Schrödinger. Avec cette équation, vous pouvez connaître la probabilité de trouver un électron à un certain point d'un atome.
Dans ce modèle, chaque électron se déplace dans une direction spécifique, qui est déterminée par quatre nombres quantiques, qui sont: le nombre quantique principal, le nombre quantique secondaire, le nombre quantique magnétique et le numéro quantique.
Il n'y a pas deux électrons qui possèdent des nombres quantiques identiques, comme l'a déclaré le principe d'exclusion découvert par le physicien Wolfgang Pauli.
Les références
- (2010). Atome. Encyclopédie moderne britannique.
- (s. F.). Modèle atomique démocrite, atomisme philosophique. Tiré de l'énergie-nucléaire.filet.
- (s. F.). Modèle atomique de Sommerfeld, extension au modèle Bohr. Tiré de l'énergie-nucléaire.filet.
- Bertsch, g. F.; Trefil, James et McGrayne, Sharon Bertsch (2021). Atome. Encyclopédie Britannica. Pris de Britannica.com.
- Duignan, b. (2021). Démocrite. Encyclopédie Britannica. Pris de Britannica.com.
- Contributeurs de New World Encyclopedia. (2021). Atome. Pris de newworldyclopedia.org.
- Zita, Ana. (s. F.). Modèles atomiques. Tiré de la todamateria.com.

