Modèle mécanique quantique de l'atome
- 703
- 58
- Adrien Remy
Quel est le modèle mécanique quantique de l'atome?
Il Modèle mécanique quantique de l'atome Il suppose que cela est formé par un noyau central formé par des protons et des neutrons. Les électrons, de charge négative, enveloppent le noyau dans les régions diffuses appelées orbitales.
La forme et l'extension des orbitales électroniques sont déterminées par plusieurs amplitudes: le potentiel central et les niveaux d'énergie quantifiés et le moment angulaire des électrons.
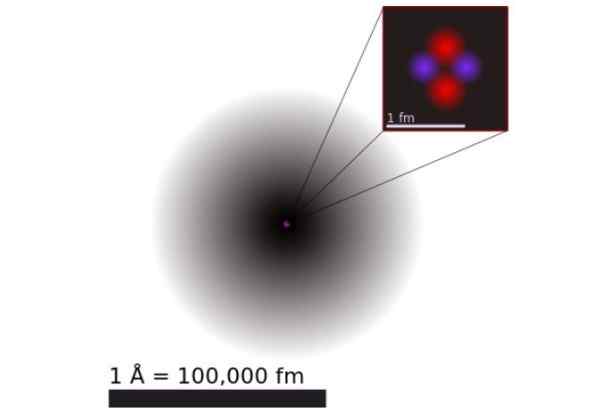
 Figure 1. Modèle d'un atome d'hélium selon la mécanique quantique. Il se compose du nuage de probabilité des deux électrons d'hélium qui entourent un noyau positif 100 000 fois plus petit. Source: Wikimedia Commons.
Figure 1. Modèle d'un atome d'hélium selon la mécanique quantique. Il se compose du nuage de probabilité des deux électrons d'hélium qui entourent un noyau positif 100 000 fois plus petit. Source: Wikimedia Commons. Selon la mécanique quantique, les électrons ont un comportement à double onde-particules et l'échelle atomique est diffuse et non spécifique. Les dimensions de l'atome sont pratiquement déterminées par l'extension des orbitales électroniques entourant le noyau positif.
La figure 1 montre la structure de l'atome d'hélium, qui a un noyau avec deux protons et deux neutrons. Ce noyau est entouré du nuage de probabilité des deux électrons qui entourent le noyau, qui est cent mille fois plus petit. Dans l'image suivante, vous pouvez voir l'atome d'hélium, avec les protons et les neutrons dans le noyau et les électrons en orbitales.

La taille d'un atome d'hélium est de l'ordre d'un angstrom (1 Å), c'est-à-dire 1 x 10 ^ -10 m. Tandis que la taille de son noyau est de l'ordre d'un clostomètre (1 fm), c'est-à-dire 1 x 10 ^ -15 m.
Bien qu'il soit si petit comparativement, 99,9% du poids atomique est concentré dans le petit noyau. C'est parce que les protons et les neutrons sont 2 000 fois plus lourds que les électrons qui les entourent.
Peut vous servir: les 31 types de force en physique et leurs caractéristiquesÉchelle atomique et comportement quantique
L'un des concepts qui a eu le plus d'influence sur le développement du modèle atomique était celui de la dualité Vague - particule: La découverte que chaque objet matériel a une vague de matière associée.
La formule qui permet de calculer la longueur d'onde λ Associé à un objet matériel a été proposé par Louis de Broglie en 1924 et est le suivant:
λ = h / (m v)
Où H C'est la constante de Planck, m la pâte et V la vitesse.
Selon le principe de De Broglie, chaque objet a un double comportement, mais en fonction de l'échelle des interactions, de la vitesse et de la masse, le comportement des vagues peut être plus prééminent que la particule ou vice versa.
L'électron est léger, sa masse est de 9,1 × 10 ^ -31 kg. La vitesse typique d'un électron est de 6000 km / s (cinquante fois moins que la vitesse de la lumière). Cette vitesse correspond aux valeurs d'énergie dans la plage de dizaines d'électrons-voltio.
Avec les données précédentes, et en utilisant la formule De Broglie, la longueur d'onde de l'électron peut être obtenue:
λ = 6,6 x 10 ^ -34 J S / (9,1 × 10 ^ -31 kg 6 x 10 ^ 6 m / s) = 1 x 10 ^ -10 m = 1 Å
L'électron aux énergies typiques des niveaux atomiques, a une longueur d'onde du même ordre de grandeur que celle de l'échelle atomique, de sorte que sur cette échelle, elle a un comportement ondulé et non de particules.
Premiers modèles quantiques
Avec l'idée à l'esprit que l'électron à l'échelle atomique a un comportement ondulé, les premiers modèles atomiques basés sur des principes quantiques ont été développés. Parmi ceux-ci, le modèle atomique de Bohr se démarque, qui prédit parfaitement le spectre d'émission d'hydrogène, mais pas celui des autres atomes.
Peut vous servir: effort de tension: formule et équations, calcul, exercicesLe modèle de Bohr et par la suite celui de Sommerfeld, étaient des modèles semi-classiques. C'est-à-dire que l'électron était en tant que particule soumise à la force d'attraction électrostatique du noyau qui autour de lui, régie par la deuxième loi de Newton.
De plus, aux orbites classiques, ces premiers modèles ont pris en compte que l'électron avait une vague de matériau associée. Seules les orbites dont le périmètre était un entier de longueurs d'onde étaient autorisées, car ceux qui ne répondent pas à ce critère est décoloré par des interférences destructrices.
C'est alors que la quantification de l'énergie dans la structure atomique apparaît pour la première fois.
Mot quantum vient précisément du fait que l'électron ne peut prendre que des valeurs d'énergie discrètes dans l'atome. Cela coïncide avec la conclusion de Planck, qui consistait en la découverte qu'un rayonnement de fréquence F Interagir avec la matière dans les packages d'énergie E = h f, où H C'est la constante de Planck.
Forme et taille orbitales
La portée radiale de l'orbitale est déterminée par le Fonction de radi d'ondeau. Est plus grand dans la mesure où l'énergie de l'électron se développe, c'est-à-dire dans la mesure où le nombre quantique principal augmente.
La distance radiale est généralement mesurée dans les radios Bohr, qui pour la plus faible énergie d'hydrogène est de 5,3 x 10-11 m = 0,53 Å.
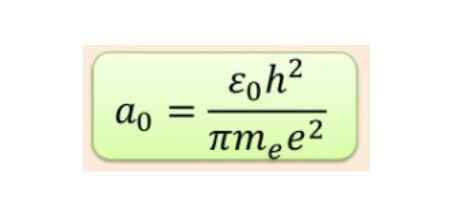 Figure 2. Formule Bohr Radius. Source: F. Zapata.
Figure 2. Formule Bohr Radius. Source: F. Zapata. Mais la forme des orbitales est déterminée par la valeur du nombre quantique de moment angulaire. Si l = 0 vous avez une orbitale sphérique appelée S, si L = 1 vous avez une orbitale lobée appelée p, qui peut avoir trois orientations selon le numéro quantique magnétique. La figure suivante montre la forme des orbitales.
Peut vous servir: magnitude vectorielle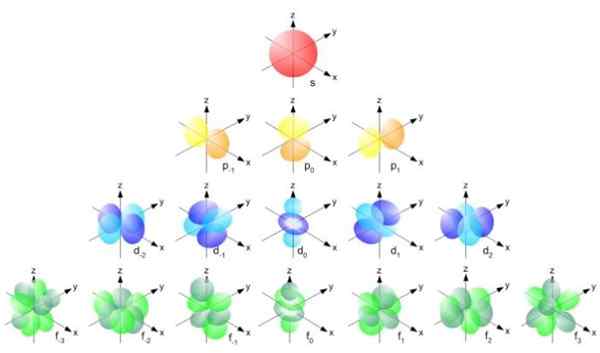 figure 3. Forme des orbitales s, p, d, f. Source: Ucdavis Chemwiki.
figure 3. Forme des orbitales s, p, d, f. Source: Ucdavis Chemwiki. Ces orbitales sont emballées au sein des autres selon l'énergie des électrons. Par exemple, la figure suivante montre les orbitales dans un atome de sodium.
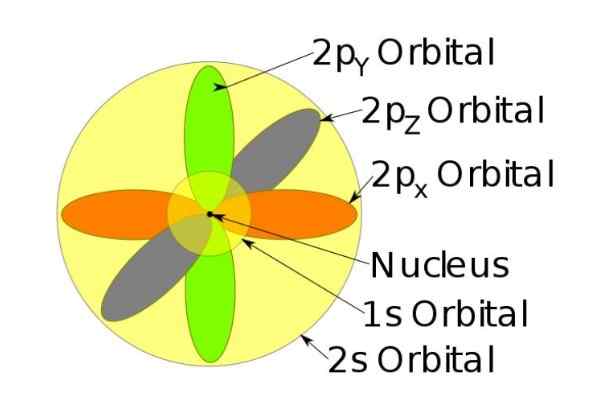 Figure 4. Orbitals 1s, 2s, 2p de l'ion sodium lorsqu'il a perdu un électron. Source: Wikimedia Commons.
Figure 4. Orbitals 1s, 2s, 2p de l'ion sodium lorsqu'il a perdu un électron. Source: Wikimedia Commons. Le rotation
Le modèle mécanique quantique de l'équation de Schrödinger n'incorpore pas le spin d'électrons. Mais Pauli est pris en compte par le principe d'exclusion, ce qui indique que les orbitales peuvent peupler jusqu'à deux électrons avec des nombres de spin quantique s = + ½ et s = -½.
Par exemple, l'ion sodium a 10 électrons, c'est-à-dire si nous nous référons au chiffre précédent, il y a deux électrons pour chaque orbitale.
Mais s'il s'agit de l'atome de sodium neutre, il y a 11 électrons, dont le dernier occuperait une orbitale 3S (non illustrée sur la figure et de plus grand rayon que les 2S). Le rotation de l'atome est décisif dans les caractéristiques magnétiques d'une substance.
Les références
- Alonso - Finn. Fondations quantiques et statistiques. Addison Wesley.
- Eisberg - Resnick. Physique quantique. Limusa - Wiley.
- Gasiorowicz. La physique quantique. John Wiley & Sons.
- HSC. Cours de physique 2. Jacaranda plus.
- Wikipédia. Modèle atomique Schrodinger. Récupéré de: Wikipedia.com

