Caractéristiques, postulats, avantages et inconvénients du modèle atomique Sommerfeld
- 1590
- 265
- Mlle Ambre Dumont
Il Modèle atomique Sommerfeld Il a été créé par le physicien allemand Arnold Sommerfeld entre 1915 et 1916, pour expliquer les faits que le modèle Bohr, publié peu de temps avant en 1913, n'a pas pu expliquer de manière satisfaisante. Sommerfeld a présenté ses résultats d'abord à la Bavière Academy of Sciences, puis les a publiés dans Annalen Der Physik Magazine.
Le modèle atome proposé par le physicien danois Niels Bohr décrit.
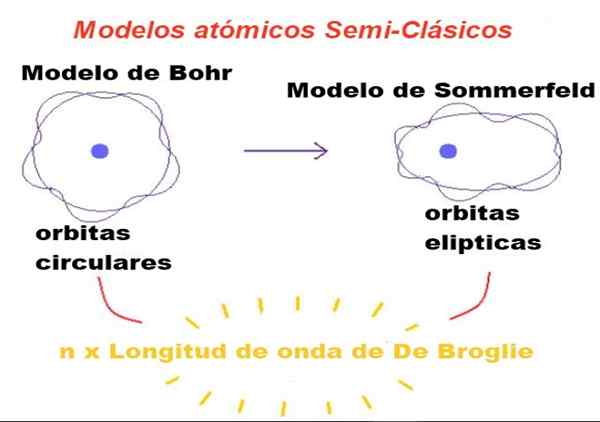
 Figure 1. Dans les modèles semi-classiques, les orbites sont newtoniennes, mais seuls ceux dont le périmètre est un nombre entier de fois que la longueur d'onde de Broglie est autorisée. Source: F. Zapata.
Figure 1. Dans les modèles semi-classiques, les orbites sont newtoniennes, mais seuls ceux dont le périmètre est un nombre entier de fois que la longueur d'onde de Broglie est autorisée. Source: F. Zapata. Dans la théorie proposée par Bohr, l'électron qui orbite autour du noyau ne peut avoir que certaines valeurs de son moment angulaire orbital, et donc il ne peut être en orbite.
Bohr a également considéré que ces orbites étaient circulaires et un seul numéro quantique appelé Numéro quantique principal n = 1, 2, 3 ... a servi à identifier les orbites autorisées.
La première modification introduite par Sommerfeld au modèle Bohr consistait à supposer que l'orbite électronique peut également être elliptique.
Une circonférence est décrite par son rayon, mais pour une ellipse, vous devez donner deux paramètres: semi -senije et demi-semi mineur, en plus de l'orientation spatiale de la même. Avec cela, il a introduit deux autres nombres quantiques.
La deuxième modification principale de Sommerfeld a été d'ajouter des effets relativistes au modèle atomique. Il n'y a rien de plus rapide que la lumière, mais Sommerfeld avait trouvé des électrons avec des vitesses rapprochées appréciables, il était donc nécessaire d'incorporer les effets relativistes dans toute description de l'atome.
[TOC]
Postule du modèle atomique sommerfeld
Les électrons suivent les orbites circulaires et elliptiques
Les électrons dans l'atome suivent l'orbite elliptique (les orbites circulaires sont un cas particulier) et leur statut énergétique peut être caractérisé par 3 nombres quantiques: le principal numéro quantique n, Le numéro quantique secondaire ou le nombre azimutal l et le nombre quantique magnétique mL.
Peut vous servir: sels binairesContrairement à la circonférence, une ellipse a une semi-je plus grande et une moitié mineure.
Mais les ellipses avec le même semi-axe majeur, ils peuvent avoir différents demi-mineurs, selon le degré d'excentricité. Une excentricité égale à 0 correspond à un cercle, donc il n'exclut pas les trajectoires circulaires. De plus, dans l'espace, les ellipses peuvent avoir des inclinations différentes.
C'est pourquoi Sommerfeld a ajouté à son modèle le numéro quantique secondaire L pour indiquer la moitié mineure et le numéro quantique magnétique mL. Il a donc souligné quelles sont les orientations spatiales autorisées de l'orbite elliptique.
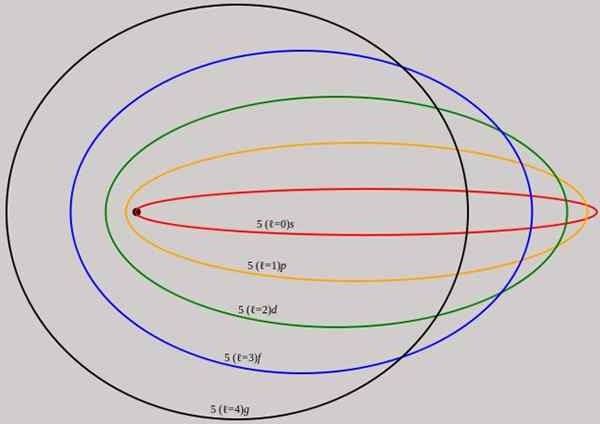 Figure 2. Les orbites correspondant au niveau d'énergie n = 5 sont affichées pour un moment angulaire différent L qui ont des longueurs d'onde complètes de De Broglie. Source: Wikimedia Commons.
Figure 2. Les orbites correspondant au niveau d'énergie n = 5 sont affichées pour un moment angulaire différent L qui ont des longueurs d'onde complètes de De Broglie. Source: Wikimedia Commons. Notez qu'il n'ajoute pas de nouveaux nombres quantiques principaux, donc l'énergie totale de l'électron en orbite elliptique est la même que dans le modèle Bohr. Par conséquent, il n'y a pas de nouveaux niveaux d'énergie, mais un déploiement des niveaux donnés par le nombre n.
Effet Zeeman et effet brutal
De cette façon, il est possible de spécifier complètement une orbite donnée, grâce aux 3 nombres quantiques mentionnés et ainsi à expliquer l'existence de deux effets: l'effet Zeeman et l'effet Stark.
Et explique ainsi le déploiement de l'énergie qui apparaît dans l'effet normal de Zeeman (il y a aussi un effet anormal de Zeeman), dans lequel une ligne spectrale est divisée en plusieurs composants lorsqu'il est en présence d'un champ magnétique.
Ce déploiement des lignes se produit également en présence d'un champ électrique, connu sous le nom d'effet stark, qui a conduit Sommerfeld à réfléchir à la modification du modèle Bohr pour expliquer ces effets.
Le noyau et les électrons atomiques se déplacent autour de son centre de masse
Après qu'Ernest Rutherford ait découvert le noyau atomique et que le fait que presque toute la masse de l'atome y est concentré, les scientifiques pensaient que le noyau était plus ou moins stationnaire.
Il peut vous servir: hydroxyde de lithium (LIOH)Cependant, Sommerfeld a postulé que le noyau et les électrons en orbite se déplacent autour du centre de masse du système, qui est bien sûr très proche du noyau. Son modèle utilise la masse réduite du système électronique du noyau, au lieu de la masse électronique.
Dans les orbites elliptiques, comme avec les planètes autour du soleil, il y a des moments où l'électron est plus proche, et dans d'autres plus loin du noyau. Par conséquent, sa vitesse est différente à chaque point de son orbite.
 figure 3.- Arnold Sommerfeld. Source: Wikimedia Commons. Gfhund [cc par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)].
figure 3.- Arnold Sommerfeld. Source: Wikimedia Commons. Gfhund [cc par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Les électrons peuvent atteindre les vitesses relativistes
Sommerfeld a introduit dans son modèle la constante de la structure fine, une constante sans dimensions liées à la force électromagnétique:
α = 1/137.0359895
Il est défini comme le quotient entre la charge d'électrons et Je carré haut et le produit entre la constante de Planck H Et la vitesse de la lumière c Dans un vide, tous multipliés par 2π:
α = 2π (e2/ h.c) = 1/137.0359895
La constante de structure fine relie trois des constantes les plus importantes de la physique atomique. L'autre est la masse de l'électron, qui n'apparaît pas ici.
De cette façon, il est lié aux électrons avec les photons (qui se déplacent à la vitesse C dans le vide), et expliquent ainsi les écarts de certaines lignes spectrales de l'atome d'hydrogène des prédictions par le modèle Bohr.
Grâce aux corrections relativistes, niveaux d'énergie avec égal n Mais différent l Ils se séparent, donnant naissance à la structure de la structure fine, à partir de là le nom du α constant.
Et toutes les longueurs caractéristiques de l'atome peuvent être exprimées en termes de cette constante.
 Figure 4. La quantification du moment angulaire L est montrée. Contrairement aux orbites circulaires, elliptique. Source: F. Zapata.
Figure 4. La quantification du moment angulaire L est montrée. Contrairement aux orbites circulaires, elliptique. Source: F. Zapata. Avantages et inconvénients
avantage
-Sommerfeld a montré qu'un seul nombre quantique était insuffisant pour expliquer les lignes spectrales de l'atome d'hydrogène.
-C'était le premier modèle à proposer une quantification spatiale, car les projections des orbites dans le sens du champ électromagnétique.
Peut vous servir: État du plasma: caractéristiques, types et exemples-Le modèle Sommerfeld a expliqué de manière satisfaisante que les électrons avec le même nombre quantique principal diffèrent dans leur état d'énergie, car ils peuvent avoir des nombres quantiques différents L et ML.
-A introduit le α constant pour développer la structure fine du spectre atomique et expliquer l'effet Zeeman.
-Il comprenait les effets relativistes, car les électrons peuvent se déplacer avec des vitesses assez proches de celles de la lumière.
Désavantages
-Son modèle n'était applicable qu'aux atomes avec un électron et à bien des égards aux atomes des métaux alcalins tels que Li2+, Mais il n'est pas utile dans l'atome d'hélium, qui a deux électrons.
-N'a pas expliqué la distribution électronique dans l'atome.
-Le modèle a permis de calculer les énergies des états autorisés et les fréquences du rayonnement émises ou absorbées dans les transitions entre les états, sans donner d'informations sur les temps de ces transitions.
-Maintenant, il est connu que les électrons ne suivent pas les trajectoires avec des formes prédéterminées comme des orbites, mais qu'ils occupent Orbitales, Régions spatiales correspondant aux solutions d'équation de Schrodinger.
-Le modèle a combiné arbitrairement les aspects classiques avec des aspects quantiques.
-Il n'a pas expliqué l'effet anormal de Zeeman, car cela est nécessaire par le modèle Dirac, qui a ensuite ajouté un autre numéro quantique.
Articles d'intérêt
Modèle atomique Schrödinger.
Modèle atomique broglie.
Modèle atomique de Chadwick.
Modèle atomique Heisenberg.
Modèle atomique perrin.
Modèle atomique Thomson.
Modèle atomique de Dalton.
Modèle atomique de Dirac Jordan.
Modèle atomique de leucipo.
Modèle atomique bohr.
Modèle atomique actuel.
Les références
- Cerveau. Modèle d'atomes Sommerfeld et ses inconvénients. Récupéré de: cervekart.com.
- Comment nous avons appris le cosmos: Light & Matter. L'atome de Sommerfeld. Récupéré de: Tasteargarden.co.ROYAUME-UNI
- Parker, P. L'atome de Bohr-Sommerfeld. Récupéré de: Physnet.org
- Coin éducatif. Modèle sommerfeld. Récupéré de: Rinconucative.com.
- Wikipédia. Modèle atomique Sommerfeld. Récupéré de: est.Wikipedia, org.
- « Quelles sont les composantes naturelles de la terre?
- Formule générale Équations quadratiques, exemples, exercices »

