Modèle atomique broglie
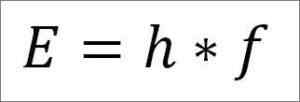
- 4162
- 55
- Anaïs Julien
Il Modèle atomique broglie Il a été proposé par le physicien français Louis Broglie en 1924. Dans sa thèse de doctorat, Broglie a déclaré que la dualité ondulée-particule des électrons, posant les fondements de la mécanique ondulée. Broglie a publié des résultats théoriques importants sur la nature des vagues-corpusculus.
Par la suite, les déclarations de Broglie ont été démontrées expérimentalement par les scientifiques Clinton Davisson et Lester Germer, en 1927. La théorie des vagues des électrons de Broglie est basée sur la proposition d'Einstein sur les propriétés ondulatrices de la lumière en courtes longueurs d'onde.
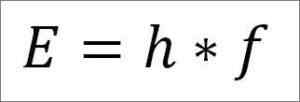 Louis Broglie
Louis Broglie Broglie a annoncé la possibilité que la matière ait un comportement similaire à celle de la lumière et a suggéré des propriétés similaires dans les particules subatomiques telles que les électrons.
Les charges électriques et en orbite restreignent l'amplitude, la longueur et la fréquence de l'onde décrite par les électrons. Broglie a expliqué le mouvement des électrons autour du noyau atomique.
[TOC]
Caractéristiques du modèle atomique de Broglie
Pour développer leur proposition, Broglie a commencé à partir du principe selon lequel les électrons avaient une double nature entre l'onde et la particule, similaire à la lumière.
En ce sens, Broglie a fait une comparaison entre les deux phénomènes, et sur la base des équations développées par Einstein pour l'étude de la nature ondulée de la lumière, a déclaré ce qui suit:
- L'énergie totale du photon et, par conséquent, l'énergie totale de l'électron, résulte du produit de la fréquence des vagues et de la constante de la planche (6 62606957 (29) × 10 -3. 4 Jules x secondes), comme détaillé dans l'expression suivante:
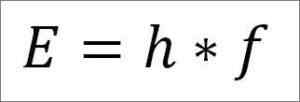
Dans cette expression:
E = énergie électronique.
H = constante de la planche.
F = fréquence des vagues.
- Le moment linéaire du photon, et donc de l'électron, est inversement proportionnel à la longueur de l'onde, et les deux amplitudes sont liées à travers la constante de la planche:
Peut vous servir: Osmose inversée: comment cela fonctionne, à quoi sert-il, des exemples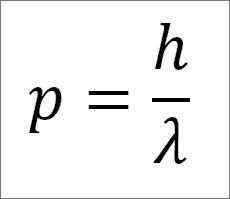
Dans cette expression:
P = moment linéaire de l'électron.
H = constante de la planche.
λ = longueur d'onde.
- Le moment linéaire est le produit de la masse de la particule en raison de la vitesse que cette particule a pendant son déplacement.
Si l'expression mathématique précédente est restructurée en fonction de la longueur d'onde, ce qui suit est:
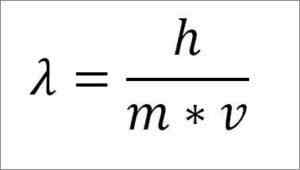
Dans cette expression:
λ = longueur d'onde.
H = constante de la planche.
M = masse électronique.
V = vitesse électronique.
Puisque H, la constante de la planche, a une petite valeur, la longueur d'onde λ est également. Par conséquent, il est possible de déclarer que les propriétés des vagues de l'électron ne sont présentées qu'aux niveaux atomiques et subatomiques.
- Broglie est également basée sur les postulats du modèle atomique Bohr. Selon ce dernier, les orbites des électrons sont limitées et ne peuvent être que des multiples de nombres entiers. Donc:
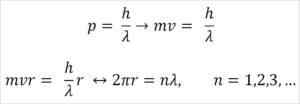
Où:
λ = longueur d'onde.
H = constante de la planche.
M = masse électronique.
V = vitesse électronique.
R = rayon d'orbite.
n = nombre entier.
Selon le modèle atomique de Bohr, auquel Broglie a adopté comme base, si les électrons se comportent comme des ondes stationnaires, les seules orbites autorisées sont celles dont le rayon est égal à un multiple entier de la longueur d'onde λ.
Par conséquent, toutes les orbites ne sont pas conformes aux paramètres nécessaires pour qu'un électron puisse se mobiliser à travers ces. Voici pourquoi les électrons ne peuvent se déplacer que dans des orbites spécifiques.
La théorie des vagues des électrons de Broglie justifiait le succès du modèle atomique de Bohr pour expliquer le comportement électronique unique de l'atome d'hydrogène.
Peut vous servir: batterie sècheDe même, il a également expliqué pourquoi ce modèle ne s'est pas ajusté à des systèmes plus complexes, c'est-à-dire des atomes avec plus d'un électron.
Expérience Davisson et Germer
Le contrôle expérimental du modèle atomique de Broglie a eu lieu 3 ans plus tard de sa publication, en 1927.
Les physiciens américains éminents Clinton J. Davisson et Lester Germer ont expérimentalement confirmé la théorie de la mécanique ondulée.
Davisson et Germer ont effectué des tests de dispersion d'un faisceau d'électrons à travers un cristal nickel et ont observé le phénomène de diffraction à travers l'environnement métallique.
L'expérience réalisée consistait à effectuer la procédure suivante:
- Dans le premier cas, un ensemble avec un faisceau d'électrons a été placé qui avait une énergie initiale connue.
- Une source de tension a été installée pour accélérer le mouvement d'électrons incitant à une différence de potentiel.
- L'écoulement du faisceau d'électrons vers un verre métallique a été dirigé; Dans ce cas, nickel.
- Le nombre d'électrons qui frappe le verre nickel a été mesuré.
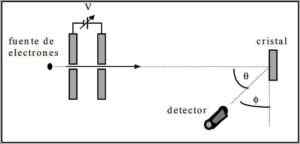
À la fin de l'expérimentation, Davisson et Germer ont détecté que les électrons se dispersaient dans différentes directions.
Lors de la répétition de l'expérience à l'aide de cristaux métalliques avec différentes orientations, les scientifiques ont détecté ce qui suit:
- La dispersion du faisceau d'électrons à travers le verre métallique était comparable au phénomène d'interférence et de diffraction des rayons lumineux.
- Le reflet des électrons sur le verre d'impact a décrit la trajectoire qui, théoriquement, devrait décrire selon la théorie des ondes d'électrons de Broglie.
En bref, Davisson et Germer Experiment ont prouvé expérimentalement la nature à double onde des électrons.
Peut vous servir: lien covalent polaire: caractéristiques et exemplesLimites
Le modèle atomique de Broglie ne prédit pas l'emplacement exact de l'électron sur l'orbite dans laquelle il se déplace.
Dans ce modèle, les électrons sont perçus comme des vagues qui sont mobilisées dans toute l'orbite sans emplacement spécifique, qui introduit le concept d'orbital électronique.

De plus, le modèle atomique de Broglie, analogue au modèle Schrödinger, ne considère pas la rotation des électrons sur le même axe (rotation).
En ignorant le moment angulaire intrinsèque des électrons, les variations spatiales de ces particules subatomiques sont laissées de côté.
Dans le même ordre d'idées, ce modèle ne prend pas en compte également les changements dans le comportement des électrons rapides en raison des effets relativistes.
Articles d'intérêt
Modèle atomique Schrödinger.
Modèle atomique de Chadwick.
Modèle atomique Heisenberg.
Modèle atomique perrin.
Modèle atomique Thomson.
Modèle atomique de Dalton.
Modèle atomique de Dirac Jordan.
Modèle atomique démocrite.
Modèle atomique de leucipo.
Modèle atomique bohr.
Modèle atomique actuel.
Les références
- Bohr's Quantum Theory et de Broglie Waves (S.F.). Récupéré de: ne.Chèque.Kyushu-u.CA.J
- Louis de Broglie - Biographical (1929). © La Fondation Nobel. Récupéré de: Nobelprize.org
- Louis-Victor de Broglie (S.F.). Récupéré de: Chemed.Chem.Purger.Édu
- Lovett, b. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Récupéré de: Britannica.com
- Modèle atomique de Broglie. Université nationale d'éducation à distance. Espagne. Récupéré de: OCW.Innover.Nond.est
- Louis de Broglie.F.). Récupéré de: Hiru.EUS
- Von Pamel, ou., Et Marchisio, s. (s.F.). Mécanique quantique. Université nationale de Rosario. Récupéré de: fceia.A R.Édu.ardente

