Modèle atomique actuel

- 2711
- 509
- Jade Duval
Quel est le modèle atomique actuel?
Il Modèle atomique actuel C'est celui basé sur la mécanique quantique, en particulier dans l'équation de Schrödinger, dans le principe d'exclusion de Pauli et une propriété de l'électron appelé rotation soit Faire un espine.
C'est le modèle de plus grande acceptation et utilisation dans l'étude de la structure des atomes, des molécules et de la réactivité chimique des éléments, en raison de la précision de leurs prédictions et de leur simplicité relative.
 Figure 1. Atome d'hydrogène dans un état excité et ses nombres atomiques: énergie n = 4, moment angulaire l = 3 et moment magnétique m = 1. Source: Wikimedia Commons.
Figure 1. Atome d'hydrogène dans un état excité et ses nombres atomiques: énergie n = 4, moment angulaire l = 3 et moment magnétique m = 1. Source: Wikimedia Commons. Ce modèle est l'évolution de plusieurs modèles atomiques précédents, tels que le modèle Rutherford et celui de Bohr - Sommerfeld, considéré comme des modèles classiques ou semi-classiques.
Il existe actuellement des modèles théoriquement plus complets que le modèle typisique de Schrödinger, comme le modèle Dirac-Jordan, qui intègre la relativité spéciale et est basé sur l'équation des ondes Dirac. Dans cette équation, le spin, la propriété des électrons mentionnés au début, apparaît naturellement.
Il existe également des modèles basés sur la théorie des champs quantiques, appliquée en physique à haute énergie. Ces modèles sont excellents dans la prédiction de la création et de l'annihilation des particules fondamentales, l'objectif de ce domaine de la physique.
Il convient de mentionner que les théories les plus sophistiquées convergent vers les mêmes résultats que ceux de l'équation de Schrödinger, en particulier pour les atomes légers.
Caractéristiques actuelles du modèle atomique
Dans la vision de l'atome actuel, basé sur le quantum non relativiste, il n'y a pas de concept d'orbits électroniques dans le style des systèmes planétaires.
Cependant, l'image la plus répandue de l'atome est toujours celle d'un noyau central positif et de certains points de charge électrique négatifs (électrons), transformant des orbites parfaitement définies autour du noyau central. Mais malgré ses racines, il ne correspond plus au modèle atomique actuel.
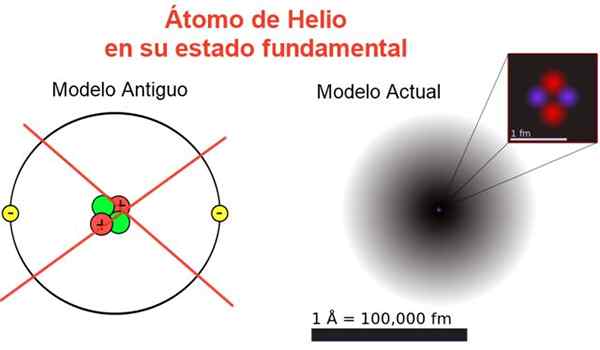 Figure 2. Image classique et actuelle de l'atome d'hélium dans son état fondamental. Dans le modèle actuel, les deux électrons de l'atome d'hélium sont dispersés dans une région appelée orbitale. Source: Wikimedia Commons, votre propre composition.
Figure 2. Image classique et actuelle de l'atome d'hélium dans son état fondamental. Dans le modèle actuel, les deux électrons de l'atome d'hélium sont dispersés dans une région appelée orbitale. Source: Wikimedia Commons, votre propre composition. La figure 2 montre l'ancienne image et l'image actuelle d'un atome d'hélium dans son état d'énergie plus petit (niveau n = 1 et l = 0).
Il peut vous servir: Accélération moyenne: comment il est calculé et résoluL'image classique est utile pour voir que le noyau contient deux protons et deux neutrons. Garantissant la neutralité de l'atome, il y a deux électrons occupant le même niveau d'énergie.
Du reste, c'est une image loin de la réalité, car l'échelle du noyau ne correspond même pas à celle de l'atome: le noyau est 1/100000 fois la taille de l'atome, mais c'est là que la masse atomique est concentrée.
Dualité onda - particule
La mécanique classique établit que chaque particule matérielle a une onde associée, appelée Fonction d'onde. C'est le célèbre Dualité onda-particule De Louis de Broglie.
Dans le modèle atomique actuel, le comportement de l'électron à l'échelle des atomes est bien ondulé, tandis qu'au niveau macroscopique, comme les électrons qui se déplacent dans les tubes à rayons cathodiques des anciens téléviseurs, le comportement corpusculaire prédomine prédomine.
D'un autre côté, avec des photons, cela se produit au contraire, dans la plupart des phénomènes optiques (au niveau macroscopique), ils ont un comportement fondamentalement ondulatoire. Et quand ils interagissent avec les questions de matière, ils ont un comportement de particules.
Pour cette raison, les électrons autour du noyau sont dispersés dans des zones appelées orbitales atomiques, dont la forme et l'extension dépendra du niveau d'énergie des électrons et de l'élan angulaire.
L'énergie et le moment angulaire de l'électron autour du noyau ont certaines valeurs autorisées, donc il est dit qu'ils sont quantifié.
L'équation des vagues Schrödinger prédit quelles valeurs d'énergie et le moment angulaire sont autorisés, ainsi que la fonction d'onde associée à chaque niveau d'énergie et de momentum.
Le carré mathématique de la fonction d'onde détermine les orbitales, c'est-à-dire les zones autour du noyau où les électrons peuvent être trouvés plus probables.
La taille de l'atome
Pour avoir une image d'échelle du modèle atomique actuel, imaginons qu'un atome a un diamètre comme celui d'un terrain de football. Le noyau serait comme une fourmi au centre du champ, mais avec étonnamment avec 99,9% de la masse atomique.
D'un autre côté, les électrons seraient des joueurs fantomatiques diffus sur tout le terrain, avec une plus grande probabilité d'être trouvé au milieu de terrain.
Peut vous servir: variable catégorique: caractéristiques et exemplesIl y a quelques alignements ou des moyens autorisés à occuper le champ, qui dépendent de l'énergie des joueurs (électrons) et de la quantité de «virage» ou de tourner autour du centre.
Le modèle atomique actuel postule
1.- L'électron est caractérisé par sa masse m, par sa rotation s Et pour être la particule de support de charge négative élémentaire (-e).
2.- Les électrons ont un comportement double en forme d'onde, mais en fonction de leur énergie et de l'échelle du phénomène peut être plus prépondérant que l'autre.
3.- Les électrons entourent le noyau atomique positif, afin qu'ils garantissent la neutralité électrique de l'atome. Par conséquent, la quantité d'électrons est égale à celle des protons; c'est lui numéro atomique, Cela confère les caractéristiques chimiques et physiques de chaque élément.
4.- L'interaction entre les électrons et le noyau est modélisée par le potentiel V (r) Électrostatique de Coulomb, qui est incorporée dans le terme énergie potentielle dans l'opérateur hamiltonien.
5.- Le terme d'énergie cinétique dans l'opérateur hamiltonien est un opérateur construit à partir de l'opérateur de momentum linéaire, étant le même:
p = - i ħ ∂ / ∂r
Où ħ est la constante de Planck divisée par 2π.
6.- L'opérateur hamiltonien h = (P⋅p)/ 2m - e v (r) agir sur la fonction d'onde électronique ψ (r).
7.- Comme les solutions stationnaires de la fonction d'onde électronique sont recherchées, l'équation de temps de Schrödinger indépendante est utilisée:
H ψ (r) = E ψ (r)
Où e représente l'énergie totale de l'électron.
8.- Dans les atomes avec plusieurs électrons, l'interaction entre eux n'est pas prise en compte.
9.- En ce qui concerne les atomes de nombreux électrons, les orbitales des électrons les plus externes sont modélisées par le potentiel du noyau blindé par les électrons les plus internes, appelés potentiels Debye.
dix.- L'équation (7) a une solution pour certaines valeurs d'énergie discrètes, de sorte que les célébrités Combien de Planck, Ils apparaissent naturellement à partir des solutions d'équation de Schrödinger.
Il peut vous servir: vagues stationnaires: formules, caractéristiques, types, exemplesonze.- Pour chaque valeur discrète, il y a une fonction d'onde. Mais certaines solutions sont dégénérées, selon la valeur du moment angulaire L.
12.- La fonction d'onde est le produit d'une fonction radiale, de la fonction azimutale et de la fonction polaire.
13.- Cette fonction d'onde détermine les régions autorisées pour l'électron. Le carré de la fonction d'onde est le densité de probabilité pour trouver l'électron dans une certaine position, vu du centre du noyau atomique.
14.- Le spin n'apparaît pas dans l'équation de Schrödinger, mais est incorporé dans le modèle atomique par le principe de Pauli:
L'électron est un fermion avec deux états possibles de spin + ½ et -½.
Ainsi, le même État caractérisé par des nombres quantiques n, l, m de l'équation de Schrödinger, peut être occupé au plus par 2 électrons avec des opposés opposés opposés. De cette façon, l'espin devient le quatrième numéro quantique.
Scientifiques influents dans le modèle atomique actuel
Cela semble incroyable, mais la plupart des physiciens qui ont contribué au modèle atomique actuel apparaissent sur la même photo. Ils se sont réunis dans les célèbres conférences parrainées par Ernest Solvay, chimiste et industriel d'origine belge, qui est devenue célèbre dans le monde de la science.
Ils ont commencé à se tenir depuis 1911 et ont réuni les plus grands scientifiques du moment, parmi lesquels étaient pratiquement tous ceux qui ont apporté leur contribution au modèle atomique actuel.
La plus célèbre de ces conférences a eu lieu à Bruxelles en 1927 et là cette photographie historique a été prise:
 figure 3. 1927 Participants de la Conférence de Solvay à Bruxelles. Source: Wikimedia Commons.
figure 3. 1927 Participants de la Conférence de Solvay à Bruxelles. Source: Wikimedia Commons.  Figure 4. Les participants à la conférence Solvay 1927.
Figure 4. Les participants à la conférence Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Théophile Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max né
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Bilouin
- Niels Bohr
- Owen Williams Richardson
Articles d'intérêt
Modèle atomique Schrödinger.
Modèle atomique broglie.
Modèle atomique de Chadwick.
Modèle atomique Heisenberg.
Modèle atomique perrin.
Modèle atomique Thomson.
Modèle atomique de Dalton.
Modèle atomique de Dirac Jordan.
Modèle atomique démocrite.
Modèle atomique de leucipo.
Modèle atomique bohr.
Les références
- Alonso - Finn. Fondations quantiques et statistiques. Addison Wesley.
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. Volume 1. Mc Graw Hill.
- Eisberg et Resnick. Physique quantique. Limusa - Wiley.
- Wikipédia. Théorie atomique. Récupéré de: est.Wikipédia.com
- Zapata f. Modèle typocutique de l'atome. Récupéré de:.com

