Myoglobine
- 4836
- 615
- Jade Duval
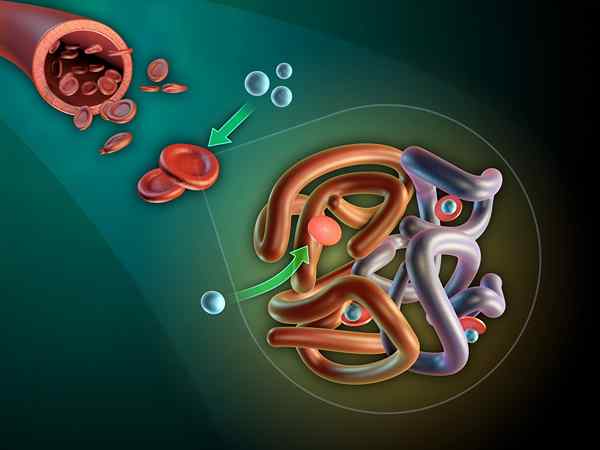
 Structure de la myoglobine
Structure de la myoglobine Qu'est-ce que Myoglobin?
La Myoglobine C'est une protéine globulaire intracellulaire trouvée dans le cytosol des cellules musculaires squelettiques et cardiaques. Sa fonction fondamentale est de constituer une réserve d'oxygène et de favoriser le transport intracellulaire de l'oxygène.
John Kendrew et Max Perutz ont reçu le prix Nobel de chimie en 1962 pour leurs études sur les protéines globulaires. Ces auteurs élucident la structure à trois dimensions de la myoglobine et de l'hémoglobine, respectivement. Historiquement, la myoglobine a été l'une des premières protéines dont la structure à trois dimensions a été déterminée.
Les protéines globulaires sont des molécules compactes avec une forme sphérique; Ils sont solubles dans le cytosol ou dans la partie lipidique des membranes cellulaires. Ils sont responsables des principales actions biologiques, par opposition aux protéines fibreuses, dont les principales fonctions sont structurelles.
La myoglobine donne du rouge de la viande fraîche. Cela se produit lorsque la myoglobine est oxygénée en tant qu'oxioglobine et que le fer qui le compose est dans le fer ferreux: MB-FE2 + O2.
Lorsque la viande est exposée à l'environnement, ferreux, instable, oxydé et devient ferrique et dans ces conditions, la couleur se transforme en tons bruns pour la formation de métamioglobine (MB-FE3 + + O2 ● -).
Normalement, les niveaux de myglobine sanguin sont très petits, ils sont dans l'ordre des microgrammes par litre (μg / L). Ces niveaux augmentent lorsque la destruction musculaire se produit comme dans la rhabdomyolyse du muscle squelettique ou en cas d'infarctus cardiaque avec destruction tissulaire et dans certaines myopathies.
Sa présence dans l'urine est observée dans certaines conditions dans lesquelles les dommages tissulaires sont très importants. Sa valeur diagnostique précoce pour l'infarctus du cardiaque est discutable.
Peut vous servir: Core cellulaireStructure de la myoglobine
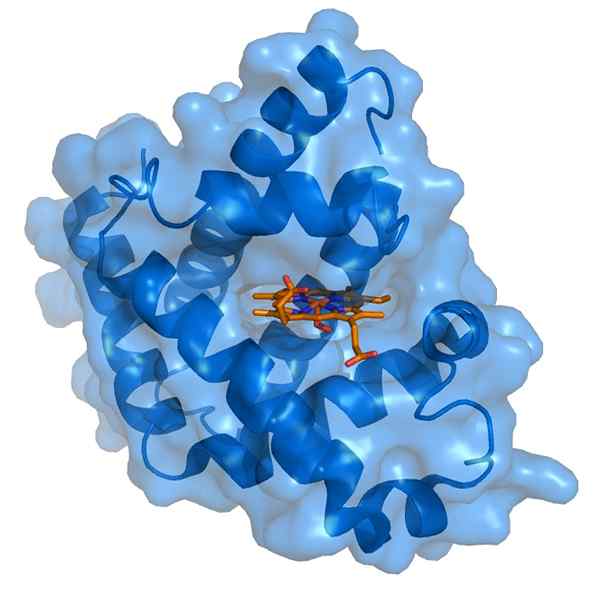 Myoglobin et son groupe prothétique Hemo (Source: Thomas Spletttsser / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons)
Myoglobin et son groupe prothétique Hemo (Source: Thomas Spletttsser / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0) via Wikimedia Commons) La myoglobine a un poids moléculaire de près de 18 kDa, dont le groupe Hemo. Il est composé de quatre segments hélicoïdaux unis par des "virages soudains". Ces hélices de myoglobine sont étroitement emballées et maintiennent leur intégrité structurelle même lorsque le groupe Hemo est retiré.
La structure des protéines globulaires, ainsi que toutes les protéines cellulaires, sont hiérarchiques, donc la structure de la myoglobine est également. Le premier niveau est la structure principale formée par la séquence linéaire des acides aminés et la myoglobine est constituée d'une chaîne d'acides aminés de 153.
La structure secondaire de la myoglobine consiste en la formation de l'hélice Alpha. La myoglobine contient 8 hélices alpha formées par des parties polypeptidiques répétées qui se lient par de courts segments de gestion de l'apériade.
La structure tertiaire se compose d'une conformation à trois dimensions avec l'activité biologique. Les caractéristiques les plus importantes de cette structure sont le pliage. La structure quaternaire se réfère à l'assemblage de deux chaînes polypeptidiques séparées et uniques à travers des liaisons ou des interactions non covalentes.
La myoglobine a une structure très compacte, avec des déchets hydrophobes dirigés vers l'intérieur et les résidus hydrophiles ou polaires dirigés vers l'extérieur. Les déchets apolaires internes sont formés par leucine, la valine, la méthodin et la phénylalanine. Le seul déchet polaire interne est deux histidines qui ont des fonctions dans le centre actif.
Le groupe prothétique hémo est situé dans une fente de la partie intérieure apolaire de la chaîne polypeptidique polyloglobine. Ce groupe contient du fer sous forme de fer ferreux, qui se lie à l'oxygène pour former l'oxioglobine.
Peut vous servir: GLUT4: caractéristiques, structure, fonctionsFonction de myoglobine
La fonction de la myoglobine consiste à unir l'oxygène au groupe Hemo de sa structure et à former une réserve d'oxygène pour la fonction musculaire. Dans la mesure où l'oxygène est piégé dans la structure de la myoglobine dans le cytoplasme de la cellule musculaire, sa pression intracellulaire, déterminée par l'oxygène libre, reste faible.
La faible pression intracellulaire de l'oxygène maintient le gradient de l'entrée d'oxygène à la cellule. Cela favorise le passage de l'oxygène du torrent circulatoire vers la cellule musculaire. Lorsque la myoglobine sature augmente de l'oxygène intracellulaire, ce qui diminue progressivement le gradient et diminue ainsi le transfert.
La courbe de liaison à l'oxygène à la myoglobine est hyperbolique. Dans les parties initiales de la courbe, de petits changements dans la pression partielle de l'oxygène produisent de grands changements dans la saturation de la myoglobine avec de l'oxygène.
Ensuite, dans la mesure où la pression partielle de l'oxygène augmente, la saturation continue d'augmenter, mais plus lentement, c'est-à-dire une augmentation beaucoup plus importante de la pression partielle de l'oxygène est nécessaire pour augmenter la saturation de la myoglobine, et progressivement la courbe est aplatie.
Il existe une variable qui mesure l'affinité de la courbe appelée P50, cela représente la pression partielle d'oxygène nécessaire pour saturer la myoglobine contenue dans une solution de 50%. Donc, si le P50 augmente, il est dit que la myoglobine a moins d'affinité et si le P50 diminue, il est dit que la myoglobine a une plus grande affinité pour l'oxygène.
Peut vous servir: Proéritroblaste: caractéristiques, morphologie, régulation, colorationLorsque les courbes de liaison à l'oxygène avec la myoglobine et l'hémoglobine sont examinées, il est observé que pour toute pression partielle de l'oxygène, la myoglobine est saturée plutôt que l'hémoglobine, indiquant que la myoglobine a une plus grande affinité pour l'oxygène que l'oxygène que l'hémoglobine.
Types de fibres musculaires et de myoglobine
Les muscles squelettiques ont différents types de fibres musculaires dans leur composition, quelques appels à contraction lente et d'autres de contraction rapide. Les fibres de contraction rapide sont structurellement et métaboliquement adaptées aux contrats rapidement et vigoureusement et de manière anaérobie.
Les fibres de contraction lente sont adaptées pour des contractions à faible vitesse, mais plus prolongées, typiques des exercices de résistance aérobie. L'une des différences structurelles de ces fibres est la concentration de la myoglobine, qui leur donne le nom des fibres blanches et rouges.
Les fibres rouges ont une teneur élevée en myoglobine, ce qui leur donne une couleur rouge, mais qui leur permet également de maintenir de grandes quantités d'oxygène, ce qui est indispensable pour leur fonction.
Valeurs normales
Les valeurs sanguines normales pour les hommes sont de 19 à 92 µg / L et chez les femmes de 12 à 76 µg / L, cependant, il existe des différences dans les valeurs dans différents laboratoires.
Ces valeurs augmentent lorsque la destruction des muscles se produit comme dans la rhabdomyolyse du muscle squelettique, dans des brûlures étendues, des chocs électriques ou dans une nécrose musculaire étendue due à une occlusion artérielle, dans l'infarctus du myocarde et dans certaines myopathies.
Dans ces conditions, la myoglobine apparaît dans l'urine et lui donne une couleur caractéristique.

