Groupe méthyle ou méthyle

- 2513
- 561
- Raphaël Charles
Il Groupe méthyle ou méthyle C'est un substituant alquilique dont la formule chimique est Cho3. C'est le plus simple de tous les substituants gazéifiés en chimie organique, il a un seul carbone et trois hydrogènes; dérive du méthane gazeux. Parce qu'il ne peut être lié qu'à un autre carbone, sa position indique la fin d'une chaîne, sa terminaison.
Dans l'image ci-dessous, vous avez l'une des nombreuses représentations de ce groupe. Les sinuosités à votre droite indiquent que derrière le lien h3C- Il peut y avoir un atome ou un substituant; un alkyle, r, aromatique ou arilo, ar ou un groupe hétéroátomo ou fonctionnel, comme OH ou CL.
 Le groupe méthyle est le plus simple des substituants gazéifiés en chimie organique. Source: Su-NO-G [domaine public]
Le groupe méthyle est le plus simple des substituants gazéifiés en chimie organique. Source: Su-NO-G [domaine public] Lorsque le groupe fonctionnel lié au méthyl est oh, nous avons de l'alcool de méthanol, CHO3Oh; Et si c'est le CL, alors nous aurons le chlorure de méthyle, Cho3CL. Dans la nomenclature organique, il est mentionné simplement comme «méthyl» précédé du nombre de sa position dans la chaîne de carbone la plus longue.
Le groupe Metilo Ch3 Il est facile à identifier pendant les élucidations des structures organiques, en particulier grâce à la spectroscopie de résonance magnétique nucléaire carbone 13 (RMN C (RMN C13). De là après de fortes oxydations, les groupes d'acide COOH sont obtenus, étant une voie synthétique pour synthétiser les acides carboxyliques.
[TOC]
Représentations
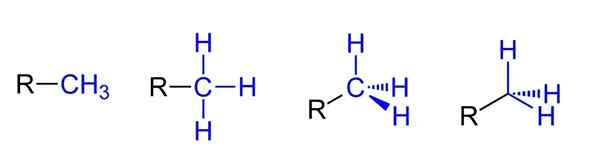 Les représentations possibles du groupe méthyle. Source: Jü via Wikipedia.
Les représentations possibles du groupe méthyle. Source: Jü via Wikipedia. Ci-dessus, vous avez les quatre représentations possibles en supposant que Cho3 Il est lié à un substituant RICO R. Ils sont tous équivalents, mais tandis que les aspects spatiaux de la molécule vont de gauche à droite.
Par exemple, R-CH3 donne l'impression qu'il est plat et linéaire. La représentation suivante montre les trois liaisons covalentes C-H, qui permettent d'identifier le méthyle dans toute structure de Lewis et de donner la fausse impression d'être un croisement.
Peut vous servir: quel est l'erristeneo?Ensuite, après la droite (l'avant-dernière), l'hybridation SP est observée3 Dans la voiture Caron3 En raison de sa géométrie tétraédrique. Dans la dernière représentation, le symbole chimique du carbone n'est même pas écrit, mais le tétraèdre est maintenu pour indiquer quels atomes H sont avant ou derrière l'avion.
Bien qu'il ne soit pas dans l'image, une autre manière très récurrente au moment de représenter Cho3 Il consiste à simplement placer le script (-) "nu". Ceci est très utile lorsque de grands squelettes de carbone sont dessinés.
Structure
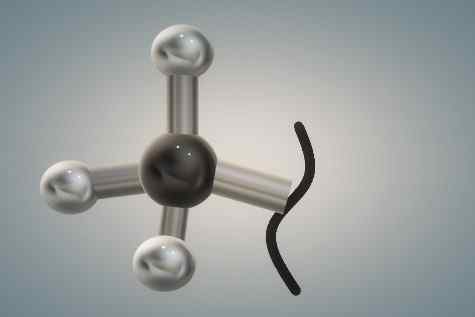 Structure du groupe méthyle représenté par le modèle de sphères et de barres. Source: Gabriel Bolívar.
Structure du groupe méthyle représenté par le modèle de sphères et de barres. Source: Gabriel Bolívar. L'image supérieure est la représentation à trois dimensions du premier. La sphère noire et brillante correspond à l'atome de carbone, tandis que les blancs sont des atomes d'hydrogène.
Encore une fois, le carbone a un produit d'environnement tétraédrique de son hybridation SP3, Et en tant que tel, c'est un groupe relativement volumineux, avec les rotations de sa liaison C-R empêchée stériquement; C'est-à-dire qu'il ne peut pas tourner parce que les sphères blanches interfèrent avec les nuages électroniques de leurs atomes voisins et sentiraient leur répulsion.
Cependant, les liens C-H peuvent vibrer, tout comme le lien C-R. Par conséquent, Cho3 C'est un groupe de géométrie tétraédrique qui peut être élucidé (déterminer, découvrir) par spectroscopie de rayonnement infrarouge (IR), comme tous les groupes fonctionnels et les liaisons carbone avec des hétéroátomos.
La chose la plus importante, cependant, est son élucidation par RMN13. Grâce à cette technique, la quantité relative de groupes méthyle est déterminée, ce qui permet à la structure moléculaire d'être assemblée.
Peut vous servir: solutions appréciéesGénéralement, plus les groupes CHA3 Avoir une molécule, plus «maladroite» ou inefficace seront ses interactions intermoléculaires; c'est-à-dire que les mineurs seront ses points de fusion et d'ébullition. Les groupes ch3, En raison de leurs hydrogènes, ils "se glissent" les uns avec les autres lorsqu'ils s'approchent ou touchent.
Propriétés
Le groupe méthyle est caractérisé par un hydrophobe et apolaire.
En effet, leurs liaisons C-H ne sont pas très polaires en raison de la faible différence entre le carbone et les électronégativités hydrogène; Et en outre, sa géométrie tétraédrique et symétrique distribue ses densités électroniques presque homogène, ce qui contribue à un moment dipolaire méprisable.
En l'absence de polarité, Cho3 "Eau" d'eau, se comportant comme un hydrophobe. Par conséquent, s'il est vu dans une molécule, il sera connu que cette extrémité méthyle n'interagira pas efficacement avec l'eau ou un autre solvant polaire.
Une autre caractéristique de ch3 C'est votre stabilité relative. À moins que l'atome qui est lié à lui de retrait de la densité électronique, reste pratiquement inerte devant de très forts moyens acides. Cependant, on verra qu'il peut participer à des réactions chimiques, principalement à son oxydation ou à sa migration (méthylation) vers une autre molécule.
Réactivité
Oxydation
Le ch3 n'est pas exempté d'oxyder. Cela signifie qu'il est susceptible de former des liens avec l'oxygène, C-O, s'il réagit avec de forts agents oxydants. À mesure qu'il s'oxyde, il devient différents groupes fonctionnels.
Par exemple, sa première oxydation donne naissance au groupe Metiol (ou à l'hydroxyméthyl), CHO2Oh, un alcool. Le second dérive dans le groupe formile, Cho (hc = o), un aldéhyde. Et la troisième finale.
Peut vous servir: constante d'ionisationCette série d'oxydations est utilisée pour synthétiser l'acide benzoïque (HOOC-C6H5) Du toluène (h3Dc6H5).
Ions
Le ch3 Pendant le mécanisme de certaines réactions, vous pouvez gagner des charges électriques momentanées. Par exemple, lorsque le méthanol est chauffé dans un milieu acide très fort, en l'absence théorique de nucléophiles (moteurs de recherche de charge positive), le cation métilal est formé3+, Puisque le lien CHO est cassé3-Oh et oh sort avec la paire d'électrons de liaison.
L'espèce ch3+ Il est tellement réactif qu'il n'a pu être déterminé que dans la phase gazeuse, car il réagit ou disparaît en la moindre présence d'un nucléophile.
D'un autre côté, Cho3 Anion peut également être obtenu: Metanuro, ch3-, Le carbanon le plus simple de tous. Cependant, comme Cho3+, Sa présence est anormale et ne se déroule que dans des conditions extrêmes.
Réaction de méthylation
Dans la réaction de méthylation, un ch est transféré3 à une molécule sans charges électriques (CHO3+ ni ch3-) Dans le processus. Par exemple, l'iodure de méthyle, CHO3I, est un bon agent méthynt et je peux remplacer la liaison O-H de plusieurs molécules avec un o-ch3.
Dans la synthèse organique, cela n'implique aucune tragédie; Mais quand ce qui est excessivement méthyl, ce sont les bases d'azote de l'ADN.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Rahul Gladwin. (23 novembre 2018). Méthylation. Encyclopædia Britannica. Récupéré de: Britannica.com
- Danielle Reid. (2019). Groupe méthyle: structure et formule. Étude. Récupéré de: étudier.com
- Wikipédia. (2019). Groupe méthyle. Récupéré de: dans.Wikipédia.org
- « Propriétés de l'égon, comment faire un enegon, exemples
- Concept et formule du volume molaire, calcul et exemples »

